 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Следствия из закона Гесса
I следствие. Тепловой эффект реакции разложения какого-либо химического соединения равен по абсолютной величине, но противоположен по знаку тепловому эффекту реакции образования этого соединения.
II следствие. Если совершаются две реакции, приводящие из различных исходных состояний к одинаковым конечным, то разница между тепловыми эффектами реакций представляет собой тепловой эффект перехода из одного исходного состояния в другое.
III следствие. Если совершаются две реакции, приводящие из одинаковых исходных состояний к различным конечным, то разница их тепловых эффектов есть тепловой эффект реакции перехода из одного конечного состояния в другое.
IV следствие. Тепловой эффект химической реакции равен сумме теплот образования конечных и исходных продуктов реакции с учетом коэффициентов перед химическими формулами этих продуктов в уравнении химической реакции.
В аналитической форме записи:
 , (3.16)
, (3.16)
где Q – тепловой эффект химической реакции;
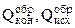 - теплоты образования конечных и исходных продуктов реакции соответственно.
- теплоты образования конечных и исходных продуктов реакции соответственно.
Теплота образования – тепловой эффект химической реакции образования данного вещества (продукта химической реакции) из простых, устойчивых в данных условиях. Стандартной теплотой образования называют теплоту образования, отнесенную к температуре 298 К и давлению 1,01 * 105 Па. Если известна эта величина, то термохимический расчет позволяет определить теплоту образования и при других значениях параметров состояния.
V следствие. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных и конечных продуктов химической реакции с учетом коэффициентов у химических формул этих веществ в уравнении химической реакции.
В аналитической форме записи:
 , (3.17)
, (3.17)
где  - теплоты сгорания конечных и исходных продуктов реакции соответственно.
- теплоты сгорания конечных и исходных продуктов реакции соответственно.
Теплота сгорания – тепловой эффект реакции сгорания 1 моля вещества в атмосфере чистого кислорода до образования высшего оксида.
Теплота сгорания существенно зависит от температуры, поэтому для термохимических расчетов вводится некоторая точка отсчета – стандартная теплота сгорания. Стандартной теплотой сгорания называется теплота сгорания, отнесенная к стандартным условиям, т. е. к 298 К и р = 1,01*105 Па.
VI следствие. Теплота растворения.
Теплотой растворения называется количество теплоты, выделяемое или поглощаемое при растворении 1 моля вещества в таком количестве растворителя, при котором его дальнейшее добавление к раствору уже не вызывает изменение температуры последнего.
В этой связи табличные значения теплот относятся к раствору 1 моля растворяемого вещества в 200 – 400 молях растворителя.
Теплота растворения (q) – сумма двух слагаемых:
q = q1 + q2, (3.18)
где q1 – теплота, затрачиваемая на перевод вещества из обычного состояния в то, в котором оно находится в растворе;
q2 – теплота взаимодействия частиц растворителя с частицами растворенного вещества (теплота сольватации или гидратации, если растворитель вода).
VII следствие. Теплота плавления и испарения.
Процессы плавления и испарения всегда эндотермические процессы, т. к. на их реализацию необходимо затратить значительную энергию на разрушение данного порядка в структуре вещества.
Между теплотой испарения ( ) и температурой кипения (ТЕ) существует взаимосвязь:
) и температурой кипения (ТЕ) существует взаимосвязь:
 , (3.19)
, (3.19)
определяемая как правило Трутона.
Существует такая же взаимосвязь для теплоты плавления (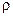 ) и температуры плавления (TS):
) и температуры плавления (TS):
 , (3.20)
, (3.20)
называемая правилом Ричардса.
VIII следствие. Теплота нейтрализации.
Реакция нейтрализации – реакция между щелочами и кислотами. В ее основе лежит процесс нейтрализации ионов водорода (Н+) ионами гидроксида (ОН-), приводящий к образованию молекул воды. Следовательно, тепловой эффект всех подобных реакций должен быть одинаков, что и показали точные опыты.
Теплота нейтрализации примерно равна 57,08 кДж/моль, если в реакции участвует одноосновная кислота
Поиск по сайту: