 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Термодинамический взгляд на энтропию
Подвод энергии к системе способом теплопередачи приводит к повышению уровня беспорядочного движения частиц в системе. Из этого следует, что при нагревании системы можно ожидать увеличения энтропии. Но записать dS = dq неоправдано по двум причинам: энтропия - функция состояния, а теплота таковой не является. С другой стороны, переход энергии к системе способом теплопередачи вызывает больший хаос в более холодной системе, чем такой же - в горячей.
Простейшее предположение состоит в том, что затраты энергии на разупорядочение в системе dq обратно пропорциональны Т.
Поэтому с термодинамической точки зрения энтропия - нечто, изменяющееся следующим образом:
 , (4.21)
, (4.21)
где Т - характеристика уже существующей разупорядоченности в системе;
dqобр - величина разупорядочивающего влияния.
Индекс “обр.” указывает, что теплопередача организавана в обратимом режиме.
Соотношение может быть получено из анализа работы тепловой машины, работающей в режиме произвольного цикла, состоящего из обратимых процессов (рис. 4.5).
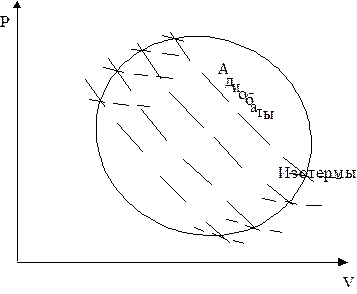
|
Если этот контур разбить большим числом адиабат, а через точки пересечения адиабат с контуром провести изотермы, то получаются бесконечно малые циклы Карно. Площади этих циклов при достаточной близости адиабат друг к другу мало отличаются по площади от циклов, ограниченных адиабатами и контуром цикла.
Из теоремы Карно для случая обратимого цикла следует:
 , (4.22)
, (4.22)
или
| Рис. 4.5. Произвольный цикл работы тепловой машины. |
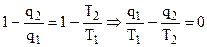 , (4.23)
, (4.23)
Для каждого из бесконечно малых циклов согласно (4.23) справедливы равенства:
 - для ‘ цикла;
- для ‘ цикла;
 - для “ цикла и т. д. (4.24)
- для “ цикла и т. д. (4.24)
Суммирование равенств (4.24) дает:
 , (4.25)
, (4.25)
где  - приведенная теплота.
- приведенная теплота.
Тогда соотношение (4.25) может быть записано в виде:
 , (4.26)
, (4.26)
т.е. алгебраическая сумма приведенных теплот равна нулю.
В пределе эта сумма переходит в интеграл, взятый по замкнутому контуру (равенство Клазиуса):
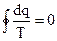 , (4.27)
, (4.27)
Так как интеграл по контуру от некоторой функции равен нулю, то подинтегральное выражение - полный дифференциал, а сама функция есть функция состояния. Эта функция названа энтропией (S).
Следовательно:
 , (4.28)
, (4.28)
и
 , (4.29)
, (4.29)
Соотношения (4.28) и (4.29) - математические выражения второго начала термодинамики, причем (4.29) справедливо только для обратимого режима ведения процесса.
При рассмотрении необратимого цикла, справедливо неравенство:
 , (4.30)
, (4.30)
тогда

или
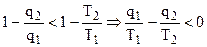 , (4.31)
, (4.31)
т. е. алгебраическая сумма приведенных теплот меньше нуля.
По аналогии с вышеизложенными:
 и
и  , (4.32)
, (4.32)
что соответствует неравенству:
 (4.33)
(4.33)
или
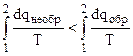 , (4.34)
, (4.34)
где
 . (4.35)
. (4.35)
После дифференцирования (4.34) окончательно:
 . (4.36)
. (4.36)
Неравенство (4.36) представляет математическую форму второго закона термодинамики для необратимых процессов.
После обобщения (4.27) и (4.32) математическая форма записи второго закона термодинамики имеет вид:
 (4.37)
(4.37)
или в дифференциальной форме записи:
 , (4.38)
, (4.38)
где знак неравенства относится к необратимым, а знак равенства - к обратимым процессам.
Поиск по сайту: