 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Общая характеристика растворов и их классификация
Растворы - гомогенные системы, состоящие из двух или более веществ. Они занимают промежуточное положение между механическими смесями или взвесями, образованными разнородными частицами, каждая из которых содержит много одинаковых молекул и индивидуальными химическими соединениями, состоящими из однородных молекул.
Один из характерных признаков растворов - их переменный состав, определяющий и свойства раствора.
С термодинамической точки зрения растворение сопровождается уменьшением энергии Гиббса системы, поэтому образование растворов - самопроизвольнный процесс, реализующийся при соприкосновении его компонентов.
Между частицами компонентов раствора действуют, как правило, слабые силы ван-дер-ваальсовской связи. Однако иногда растворение сопровождается значительным тепловым эффектом, как настоящая химическая реакция, например растворение Н2SO4 в Н2О.
Это обстоятельство привело к возникновению химической теории растворов, создателем которой был Д. И. Менделеев. С его точки зрения растворение есть химическая реакция между растворителем и растворенным веществом, а раствор - частично диссоциированное соединение переменного состава, называемое сольватом или, в случае водных растворов - гидратом.
Для выражения состава растворов существуют различные способы: массовая доля (Сi), мольная доля (Ni), объемная доля ( ) компонентов раствора. В химической практике наиболее употребительны способы: молярность (М), моляльность (m) и нормальность (N) растворов.
) компонентов раствора. В химической практике наиболее употребительны способы: молярность (М), моляльность (m) и нормальность (N) растворов.
В основе классификации растворов лежит изменение термодинамических функций при их образовании (табл. 7.1).
Изменение энтропии в идеальных растворах происходит только за счет изменения концентрации раствора. Изменение энтропии реальных растворов происходит не только за счет изменения их состава, но и за счет взаимодействия частиц растворенного вещества с частицами растворителя ( Sn).
Sn).
Таблица 7.1. Изменение термодинамических функций при образовании различных растворов.
| Термодинамические функции | Примеры | |||||||||
 H H
|  S S
|  G G
| A | 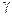
| растворов | |||||
| Идеальный раствор | ||||||||||
 H = 0 H = 0
|
 S = -RlnN S = -RlnN
|
 G = RTlnN G = RTlnN
| a = N |
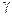 = 1 = 1
| Fe-Ni, Fe-Co, Fe-Mn | |||||
| Регулярный раствор | ||||||||||
 H H 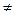 0 0
|  S = -RlnN S = -RlnN
|  G = G =  H +
+ RTlnN H +
+ RTlnN
| а 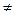 N
(a = N
(a = 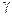 N) N)
| 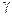 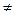 1 1
| Fe-Si, Fe-Al, Fe-Cu | |||||
| Реальный раствор | ||||||||||
 H H 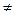 0 0
|  S = -RlnN +
+ S = -RlnN +
+  Sn Sn
|  G = G =  H +
+ RTlnN -
- Т H +
+ RTlnN -
- Т  Sn Sn
| а 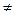 N
(a = N
(a = 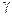 N) N)
| 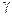 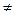 1 1
| Fe-S, Fe-С, Fe-Р | |||||
Поиск по сайту: