 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Давление насыщенного пара над раствором
Для веществ, способных переходить без разложения в газообразное состояние, одним из важных физических свойств является давление насыщенного пара этого вещества. Пусть такое вещество в твердом или жидком состоянии, находясь в замкнутом сосуде, контактирует с газовой фазой. В этом случае на поверхности раздела фаз будут протекать процессы испарения или сублимации и конденсации или десублимации. Спустя некоторое время такая система придет в состояние равновесия при определенном давлении пара, обеспечивающем равенство скоростей прямого и обратного процессов. Таким образом, при постоянной температуре давление насыщенного пара для данного вещества есть величина постоянная. Поскольку процесс испарения эндотермичен, повышение температуры будет сопровождаться повышением давления насыщенного пара. Диаграммы, выражающие зависимость между температурой и давлением насыщенного пара, называются диаграммами состояния вещества. На рис. 43 схематически изображена диаграмма состояния вещества, существующего в кристаллическом, жидком и газообразном состояниях, построенная в координатах Т, р.
Диаграмма состоит из трех полей. Поле 1 включает множество значений р и Т, отвечающих газообразному состоянию вещества, поля 2 и 3 отвечают условиям, при которых система однофазна, а вещество находится в жидком (поле 2) или твердом (поле 3) состоянии. Линии, разграничивающие указанные поля, соответствуют значениям р и Т, при которых система двухфазна. Так, кривая АО отвечает условиям, при которых в состоянии равновесия находятся твердое вещество и его пар, кривая ОВ - жидкость и пар, кривая OD - твердое вещество и жидкость. Точка О соответствует температуре и давлению, при которых в состоянии равновесия находятся пар, жидкость и кристаллы данного вещества (тройная точка). Так, для воды тройная точка отвечает температуре 273,15 К и давлению водяного пара, равному 610 Па.
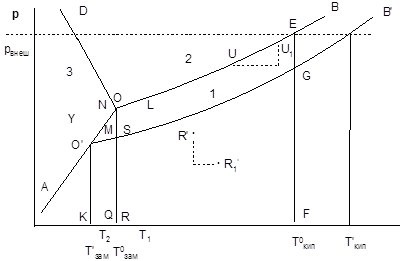
Рис. 43. Давление пара над растворителем и раствором
При изменении температуры и давления число фаз системы может изменяться. Число параметров, которые можно изменять независимо друг от друга без изменения числа фаз, называют числом степеней свободы. Последнее связано с числом компонентов и фаз системы правилом фаз Гиббса:
С + Ф = К + 2,
где С - число степеней свободы, Ф - число фаз, К - число компонентов. Если система однокомпонентна,
С = 3 – Ф
Правило фаз позволяет определить число степеней свободы для любой точке диаграммы состояния. Так, для точки R’ (рис. 43) К=1, Ф=1, откуда С=2; действительно, для этого состояния температуру и давление можно в определенных пределах менять независимо друг от друга, а система будет оставаться однофазной (например, при переходе из точки R’ в точку R1’). Для точки U K = 1, Ф = 2 и, следовательно, С = 1. Для этой точки можно произвольно изменять лишь один параметр (либо р, либо Т), а второй параметр должен изменяться строго определенным образом, чтобы точка U1 попала на кривую ОВ. Наконец, для тройной точки О число степеней свободы равно нулю; в этом случае изменение хотя бы одного параметра приводит к превращению трехфазной системы в двухфазную или однофазную.
Пусть в чистый растворитель вводят растворимое в нем нелетучее соединение. В результате концентрация этого вещества в растворе возрастает от нуля до некоторой величины, а концентрация растворителя уменьшается. В соответствии с принципом Ле Шателье равновесие
испарение
раствор  пар
пар
конденсация
должно сместиться в сторону процесса, сопровождающегося понижением концентрации растворенного вещества и повышением концентрации растворителя, т.е. процесса конденсации. Давление насыщенного пара при этом уменьшится. Отсюда следует, что давление пара над раствором ниже давления пара над чистым растворителем. Соответственно на диаграмме состояния кривая давления насыщенного пара над раствором пройдет ниже кривой ОВ (кривая О΄В΄).
Взаимосвязь между давлением насыщенного пара и концентрацией раствора отражает первый закон Рауля (1887 г.). Относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного вещества:
 ,
,
где р0 и р1 - давление насыщенного пара над растворителем и раствором, ν0 и ν1 - количества (число молей) растворителя и растворенного вещества. Преобразование уравнения приводит к формуле следующего вида
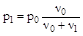
Давление пара над раствором равно, таким образом, давлению пара над чистым растворителем, умноженным на мольную долю растворителя.
Первый закон Рауля строго применим лишь для идеальных растворов. Однако ему достаточно точно следуют разбавленные растворы нелетучих неэлектролитов.
Поиск по сайту: