 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Основные положения координационной теории
Координационными называются соединения, содержащие в своем составе многоатомные молекулы или ионы, имеющие центр координации, связанный с частицами (молекулами или ионами), способными к самостоятельному существованию.
Несоблюдение хотя бы одного из перечисленных признаков не позволяет отнести то или иное соединение к координационным. Например, сульфат-анион является многоатомной тетраэдрической частицей, имеющей центр координации (атом серы).

Однако рассматривать этот анион как комплексную частицу нельзя, поскольку он состоит из частиц, не способных к самостоятельному существованию (катион серы(VI) и двухзарядный анион кислорода). Нельзя отнести к координационным соединениям и хингидрон, представляющий собой продукт соединения хинона и гидрохинона, молекулы которых многоатомны и устойчивы. Действительно, хингидрон

не имеет центра координации. Для подобных объектов более уместен термин "аддукт" (продукт присоединения). Аддукты и координационные соединения нередко объединяют под названием комплексное соединение.
Примером классического координационного соединения может служить соль Тассера, полученная еще в 1798 г., и имеющее формулу CoCl3×6NH3 или
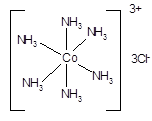
Это соединение содержит в своем составе многоатомный ион, имеющий центр координации (катион Со3+) и состоящий из частиц, способных к самостоятельному существованию.
В основе химии координационных соединений лежит координационная теория А. Вернера, предложенная в 1893 г. Основные принципы современной теории координационных соединений сводятся к следующим положениям:
1. Координационные соединения имеют центрическое строение. Атом или ион, занимающий центральное положение в комплексе, называется центральным атомом (ЦА). Вокруг центрального атома группируются остальные молекулярные или атомные частицы.
2. Ионы или молекулы, непосредственно связанные с ЦА, называются лигандами. Центральный атом и лиганды в своей совокупности образуют внутреннюю (координационную) сферу соединения.
3. Совокупность ионов и молекул, не связанных с ЦА, образует внешнюю сферу. Связь между внутренней и внешней сферами осуществляется за счет сил невалентного взаимодействия (электростатическое притяжение, водородные связи, силы межмолекулярного взаимодействия).
В случае соли Тассера центральным атомом является катион Со3+, а в роли лигандов выступают молекулы аммиака. Образуемая ими внутренняя (координационная) сфера выделена квадратными скобками и представляет катион [Co(NH3)6]3+. Заряд этого комплекса компенсируется зарядами трех ионов хлора, образующих внешнюю сферу. Связь комплекса с внешнесферными ионами имеет ионный характер.
Важнейшей характеристикой центрального атома является координационное число (КЧ). Координационное число центрального атома - это число мест в координационной сфере, образованной этим ЦА. Оно измеряется числом s-связей, образуемых ЦА со всеми лигандами. Так, для соли Тассера координационное число иона Со3+ равно шести. Координационное число может принимать различные значения. Наиболее часто оно равно 6, 4 и 2. Реже встречаются координационные числа 3, 5 и превышающие 6.
Число лигандов во внутренней координационной сфере называют лигандным числом. Поскольку лиганд может занимать во внутренней сфере несколько мест, лигандное число не всегда совпадает с координационным.
Число мест, занимаемых лигандом в координационной сфере, называется дентатностью лиганда (от греческого dentatus - имеющий зубы, зубчатый). Дентатность измеряется числом s-связей, образуемых лигандом с центральным атомом. В зависимости от дентатности, лиганды можно подразделить на следующие группы:
1. Монодентатные лиганды, образующие с ЦА одну s-связь. Примером молекулярных монодентатных лигандов могут служить NH3, H2O, CO, ионных –  .
.
2. Бидентантные лиганды, образующие с ЦА две s-связи. Примером бидентатного лиганда может служить этилендиамин H2NCH2CH2NH2 (сокращенное обозначение - en). Это соединение содержит два донорных атома азота и может занимать во внутренней сфере два места. Поэтому в соли Тассера 6 молекул аммиака могут быть замещены тремя молекулами этилендиамина с образованием комплекса [Co(en)3]Cl3:

Бидентатными лигандами являются также многие двухзарядные анионы ( и др.). Заметим, что бидентатные лиганды могут выступать и в роли монодентатных лигандов.
и др.). Заметим, что бидентатные лиганды могут выступать и в роли монодентатных лигандов.
3. Полидентатные лиганды, образующие с ЦА три и более s-связей. Так, например, триаминоэтиламин может образовывать четыре s-связи типа М←N и соответственно проявлять дентатность 4:

Анион этилендиаминтетрауксусной кислоты (ЭДТА)

способен образовывать с катионом металла 6 s-связей через два атома азота и четыре атома кислорода карбоксильной группы (гексадентатный лиганд).
Важной характеристикой комплексов является также форма координационного полиэдра - геометрической фигуры, получающейся при соединении координационных мест условными прямыми. Наиболее распространенными являются линейные (КЧ = 2), тетраэдрические (КЧ =4), квадратные (КЧ = 4) и октаэдрические (КЧ = 6) комплексы. Например, для соли Тассера координационный полиэдр имеет форму октаэдра.
Поиск по сайту: