 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Общая характеристика окислительно-восстановительных реакций
Окислительно-восстановительными реакциями (ОВР) называются процессы, сопровождающиеся изменением степени окисления элементов. Степень окисления - это формальный заряд, рассчитанный в предположении, что электроны, участвующие в образовании химических связей, полностью смещены к партнеру с большей электроотрицательностью, т.е. все химические связи рассматриваются как ионные.
При определении степени окисления элементов необходимо соблюдать ряд правил:
1. Степень окисления элемента в простом веществе равна нулю, например,Na0, O02, S08.
2. Сумма степеней окисления элементов, входящих в состав молекулы (формульной единицы), равна нулю, например:
 (+1×2 + (+6) + (-2)×4 = 0)
(+1×2 + (+6) + (-2)×4 = 0)
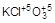 (+1 + (+5) + (-2)×3 = 0)
(+1 + (+5) + (-2)×3 = 0)
3. Сумма степеней окисления элементов, входящих в состав иона, равна его заряду, например:
 (+5 + (-2)×3 = -1)
(+5 + (-2)×3 = -1)
Ряд элементов проявляет постоянную степень окисления в своих соединениях, что несколько облегчает задачу определения степеней окисления других элементов. Так, фтор во всех своих соединениях проявляет степень окисления -1, щелочные металлы +1, щелочноземельные металлы, а также магний и бериллий +2, бор и алюминий +3, кремний +4. Водород, связанный в бинарных соединениях с металлами (в гидридах), проявляет степень окисления -1, во всех остальных случаях +1. Кислород в подавляющем большинстве соединений имеет степень окисления -2, исключения составляют перекиси, например, Н2О-12 и соединения с фтором: О+12F2 и O+2F2. Атомы хлора, брома и иода проявляют в своих соединениях степень окисления -1, за исключением тех случаев, когда они связаны с кислородом или более активным галогеном, стоящим в подгруппе выше. Остальные элементы в разных соединениях могут проявлять разную степень окисления, например: H2S-2, S+4O2, S+6O3.
Поскольку для любой химической реакции алгебраическая сумма степеней окисления элементов для каждого вещества, участвующего во взаимодействии, и для реакции в целом равна нулю, ОВР являются двуединым процессом, при протекании которого происходит повышение степени окисления одних и понижение степени окисления других элементов.
Процесс, сопровождающийся повышением степени окисления элементов, называется процессом окисления; элемент, степень окисления которого в процессе реакции повышается, называется восстановителем.
Процесс, сопровождающийся понижением степени окисления элемента, называется восстановлением; элемент, степень окисления которого понижается, называется окислителем.
Формально ОВР можно рассматривать как реакции, сопровождающиеся переносом электронов от одних атомов или ионов к другим. При таком подходе процесс, идущий с присоединением электронов является процессом восстановления окислителя, т.е. элемента, электроны присоединяющего, а процесс, протекающий с потерей электронов, является процессом окисления восстановителя, т.е. элемента, электроны отдающего. Так, например, взаимодействие олова с хлором протекает с образованием хлорида олова(IV), содержащeго полярные связи Sn-Cl со смещением электронной плотности к атомам хлора, являющегося более электроотрицательным элементом, чем олово. Соответственно степени окисления олова и хлора в простых веществах равны нулю, а в продукте взаимодействия - +4 и –1. Следует отметить, что знак степени окисления записывают перед числом в отличие от знака заряда иона, который ставят после числа, например, Sn+4 и Sn4+.
Sn0 + 2Cl  = Sn+4Cl
= Sn+4Cl 
Для этой реакции окислителем является хлор, а восстановителем - олово; процессы окисления и восстановления протекают по следующим уравнениям:
Sn0 - 4e- = Sn+4 (окисление)
Cl0 + 1e- = Cl-1 (восстановление)
Понятия "окисление" и "восстановление" распространяются также на ионы и на вещества, содержащие атомы, присоединяющие или отдающие электроны.
Различают четыре типа ОВР.
1. Межмолекулярные ОВР, при которых окислитель и восстановитель являются разными элементами, входящими в состав разных молекул, например, рассмотренная выше реакция.
2. Внутримолекулярные ОВР, в случае которых окислитель и восстановитель входят в состав одного и того же вещества. К этому типу реакций относятся реакции разложения, например,
2Hg+2O-2 = 2Hg0 + O02
3. Реакции диспропорционирования, в случае которых в качестве окислителя и восстановителя выступают атомы одного и того же элемента в одной и той же степени окисления, например,
3Cl  + 6KOH = KCl+5O3 + 5KCl-1 + 3H2O
+ 6KOH = KCl+5O3 + 5KCl-1 + 3H2O
4. Реакции сопропорционирования, для которых окислителем и восстановителем являются атомы одного и того же элемента в разных степенях окисления, которые становятся одинаковыми в продуктах реакции, например,
KI+5O3 + 5KI-1 + 3H2SO4 = 3I2 + K2SO4 + 3H2O
Поиск по сайту: