 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Температуры замерзания и кипения растворов
Вещества характеризуются определенными температурами кипения и замерзания (кристаллизации). Эти характеристики непосредственно связаны с давлением его насыщенного пара.
Температура кипения жидкости - это температура, при которой давление насыщенного пара над жидкостью становится равным внешнему давлению. При этой температуре переход жидкости в пар происходит не только с поверхности жидкости, но и во всем ее объеме, вследствие чего в жидкой фазе наблюдается непрерывное образование и рост пузырьков пара, всплывающих и разрушающихся. На рис. 43 кипению жидкости соответствует температура Т0кип, при которой давление пара над жидкостью (кривая ОВ) становится равным внешнему давлению рвнеш. При постоянном давлении температура кипения зависит от природы жидкости. Так, при стандартном давлении вода кипит при 100 оС, бензол - при 80,1 оС, этанол - при 78,4 оС.
Поскольку давление насыщенного пара над раствором меньше, чем над растворителем, растворы кипят при более высоких температурах, чем чистый растворитель. Так, при температуре Т0кип (рис. 43) давление пара над раствором (отрезок GF) будет меньше внешнего давления (отрезок EF), и раствор кипеть не будет. Чтобы раствор закипел, его необходимо нагреть до температуры Т΄кип, при которой давление насыщенного пара достигнет внешнего давления.
Температурой замерзания жидкого вещества является температура, при которой твердая и жидкая фазы находятся в состоянии равновесия. Необходимым условием равновесия между жидкой и твердой фазой является равенство значений давления насыщенного пара над жидкостью (рж) и кристаллическим твердым веществом (рк); если условие рк = рж не соблюдается, фаза с большим давлением пара переходит в фазу с меньшим давлением пара. Так, на рис. 43 равновесие между твердой и жидкой фазами будет иметь место при температуре Т0зам.
Пусть в раствор, охлажденный до температуры замерзания чистого растворителя Т0зам, поместили кристалл твердого растворителя. В такой системе давление насыщенного пара над твердой фазой (отрезок OR на рис. 43) будет больше давления пара над раствором (отрезок SR), и твердый растворитель перейдет в жидкое состояние. Для того чтобы между раствором и кристаллами твердого растворителя имело место равновесие, систему необходимо охладить до температуры Т΄зам (Т΄зам<T0зам), при которой давление пара над раствором и кристаллическим растворителем станут одинаковыми (отрезок O΄K). Таким образом, растворы замерзают при более низких температурах, чем чистый растворитель.
Ф. Рауль, изучая влияние концентрации раствора и природы растворителя на замерзание и кипение растворов, установил закономерность, называемую вторым законом Рауля. Повышение температуры кипения и понижение температуры замерзания раствора пропорционально числу частиц растворенного вещества в данной массе растворителя и не зависит от природы растворенного вещества.
Математически второй закон Рауля выражается следующими уравнениями:
ΔТкип = ECm,
ΔТзам = КСm,
где ΔТкип и ΔТзам - повышение температуры кипения и понижение температуры замерзания раствора, Сm - моляльная концентрация раствора, Е (эбулиоскопическая константа) и К (криоскопическая константа) - коэффициенты пропорциональности, зависящие от природы растворителя. Так, для воды эбулиоскопическая и криоскопическая константы равны соответственно 0,516 и 1,86, а для бензола - 2,57 и 5,12.
На втором законе Рауля основаны эбулиоскопический и криоскопический методы определения молекулярных масс растворенных веществ. Подставив в уравнения выражение для значение Сm и решив их относительно М1, получим:
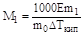 ,
,
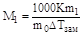
где m1 и М1 - масса и молекулярная масса растворенного вещества, m0 - масса растворителя.
Поиск по сайту: