 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Задача № 1. Через 500 мл 1М раствора едкого натра пропущено 11,2 л оксида серы (IV) при н.у
Через 500 мл 1М раствора едкого натра пропущено 11,2 л оксида серы (IV) при н.у. Какая соль и в каком количестве образовалась?
Решение:
При взаимодействии SO2 и гидроксида натрия может образоваться две соли: средняя и кислая:
SO2 + NaOH = NaHSO3 (1)
SO2 + 2NaOH = Na2SO3 + H2O (2)
Чтобы установить формулу соли, необходимо знать количественное соотношение оксида и щелочи.
Рассчитываем количества исходных веществ:
n (NaOH) = с (NaOH)× V (р-ра) = 1×0,5 = 0,5 моль;
n (SO2)= 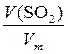 =
= 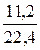 =0,5 моль.
=0,5 моль.
Так как 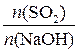 =
= 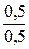 =
= 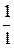 , следовательно, образовалась соль NaHSO3.
, следовательно, образовалась соль NaHSO3.
Рассчитаем количество соли:
n (NaHSO3) = n (SO2) = n (NaOH) = 0,5 моль.
Ответ: 0,5 моль NaHSO3.
Упражнения и задачи для самостоятельного решения
1. Составьте уравнения реакций, не изменяя коэффициенты к исходным веществам: H3PO4+2KOH ®; Al(OH)3+1HCl ®; Ca(OH)2+2CO2 ®; H2SO4+1NaOH ®; 2H3PO4+Ca(OH)2 ®. Назовите полученные продукты.
2. Смешали 100 мл 20%-ного раствора серной кислоты (пл.=1,14 г/мл) и 400 г 5,2%-ного раствора хлорида бария. Какая масса осадка образуется? (Ответ: 23,3 г)
3. Какой объем раствора с массовой долей соляной кислоты 30% (пл.=1,15 г/мл) пойдет на взаимодействие с карбонатом кальция массой
250 г, содержащим 20% примесей? (Ответ: 423,19 мл)
4. Смешали 120 мл 10%-ного раствора соляной кислоты (пл.=1,05 г/мл) и 200 мл 0,5М раствора нитрата серебра. Какая масса осадка образуется? (Ответ: 14,35 г)
5. Какое количество вещества гидросульфата натрия образуется при смешении 200 г 39,2%-ного раствора серной кислоты и 200 г 8%-ного раствора гидроксида натрия? (Ответ: 0,4 моль)
6. Напишите формулы всех теоретически возможных солей, отвечающих взаимодействию: а) гидроксида кальция и ортофосфорной кислоты
(4 соли); б) гидроксида железа(III) и серной кислоты (4 соли)
7. 48 г оксида железа(III) восстановили до металла нагреванием в токе СО. Образовавшийся после реакции газ пропустили через раствор, полученный действием 36 г металлического кальция на воду. Какая соль образовалась и какова ее масса? (Ответ: 90 г)
8. Раствор, содержавший 6 г едкого натра, поглотил 2,24 л СО2 (н.у.). Установите массы веществ, находящихся в растворе после поглощения СО2. (Ответ: 4,2 г NaHCO3; 5,3 г Na2CO3)
9. К раствору, содержащему 5,88 г ортофосфорной кислоты прибавили раствор, содержащий 8,4 г едкого кали. Определите состав осадка, полученного при выпаривании раствора досуха.
(Ответ: 6,3 г К3РО4; 5,22 г К2НРО4)
10. К 200 г раствора с массовой долей AlCl3 13,35% добавили 400 мл 2М раствора гидроксида натрия. Какие соли и какой массой образовались? (Ответ: 23,6 г; 35,1 г).
Поиск по сайту: