 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Задача № 2. Растворимость КNО3 при 60оС составляет 110 г, а при 0оС – 15 г
Растворимость КNО3 при 60оС составляет 110 г, а при 0оС – 15 г. Какая масса соли выпадает в осадок, если 840 г насыщенного при 60оС раствора охладить до 0оС?
Решение:
Определим, какая масса КNO3 растворяется в 840 г раствора при 60оС:
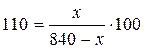 ; х = 440 г.
; х = 440 г.
Определим массу воды, в которой растворяется соль при 60оС:
m (Н2О)=840 – 440=400 г.
Рассчитаем массу соли, которая растворяется в 400 г воды при 0оС, так как масса воды в растворе при его охлаждении не изменяется:
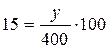 ; у = 60 г.
; у = 60 г.
Следовательно, из 440 г взятой соли при охлаждении до 0оС в растворе останется 60 г, а остальная соль выделится из раствора в виде кристаллов:
m (осадка) = 440 – 60 = 380 г.
Ответ: 380 г.
Упражнения и задачи для самостоятельного решения.
1. Вычислите коэффициент растворимости ВаСl2 в воде при 0оС, если при этой температуре в 13,1 г раствора содержится 3,1 г ВаCl2.
(Ответ: 31 г)
2. Коэффициент растворимости перманганата калия при 65оС равен
25 г/ на 100 г воды. Рассчитайте массовую долю KMnO4 (%) в насыщенном растворе (Ответ: 20%)
3. Массовая доля соли в насыщенном растворе нитрата калия при 20оС равна 24%. Вычислите коэффициент растворимости этой соли.
(Ответ: 31,6 г/100 г Н2О)
4. Коэффициент растворимости хлорида натрия при 20оС равен 35,9 г/на 100 г Н2О. Рассчитайте массу насыщенного раствора, содержащего 115,5 г соли. (Ответ: 437 г)
5. Рассчитайте коэффициент растворимости Zn(NO3)2, если в 0,3 л воды растворяется 1,8857 моль этой соли. (Ответ: 118,8 г/100 г Н2О)
6. Сколько граммов сульфата калия выпадает в осадок из 400 г раствора, насыщенного при 80оС, при его охлаждении до 20оС. Растворимость К2SO4 составляет 21,4 г/100 г Н2О при 80оС и 11,1 г/100 г Н2О при 20оС. (Ответ: 33,9 г)
 Дополнительные задания
Дополнительные задания
1. Сколько г КСl выпадет в осадок из 300 мл насыщенного при 20оС раствора КСl (пл. 1,174 г/см3), если раствор охладить до 0оС?
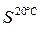 (KCl) = 34,4 г/100 г воды;
(KCl) = 34,4 г/100 г воды; 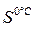 (KCl) = 28г/100 г воды.
(KCl) = 28г/100 г воды.
(Ответ: 16,8 г)
2. Коэффициент растворимости соли при 80оС равен 50 г/100 г Н2О, а при 20оС – 20 г/100 г Н2О. Определите массу осадка, полученного из 700 г, насыщенного при 80оС раствора при его охлаждении до 20оС.
(Ответ: 140 г)
3. Коэффициент растворимости СаСl2 в воде при 10оС равен 159 г на
100 г воды. Какая масса соли может раствориться в 750 г воды.
(Ответ: 1192,5 г)
4. В воде массой 100 г при температуре 20оС растворяется гидроксид натрия массой 108,7 г. Какую массу NaOH и воды надо взять для приготовления насыщенного при температуре 20оС раствора щелочи массой 40 г? (Ответ: 20,8 г NaOH; 19,2 г Н2О)
Поиск по сайту: