 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Задача № 1. Определить массовую долю H2SO4 в растворе, полученном в результате растворения 40 г оксида серы(VI) в 21,15 мл 20%-ного раствора серной кислоты (пл.=1,43
Определить массовую долю H2SO4 в растворе, полученном в результате растворения 40 г оксида серы(VI) в 21,15 мл 20%-ного раствора серной кислоты (пл.=1,43 г/мл).
Решение:
Масса H2SO4 в исходном растворе равна:
m 1(H2SO4) = V 1(р-ра)×r1(р-ра)×w1(H2SO4) = 21,15×1,43×0,2 = 6 г.
При добавлении SO3 в водный раствор H2SO4 протекает реакция:
SO3 + H2O = H2SO4
n (SO3) =  =
= 
В результате реакции образовалась H2SO4: n 2(H2SO4) = n (SO3) = 0,5 моль;
m 2(H2SO4) = 0,5 моль × 98 г/моль = 49 г.
Всего в растворе оказалось H2SO4:
m 3(H2SO4) = m 1(H2SO4) + m 2(H2SO4) = 6 + 49 = 55 г.
Масса получившегося раствора равна:
m 2(р-ра) = m 1(р-ра)+ m (SO3)= V 1(р-ра)×r1(р-ра)+ m (SO3);
m 2(р-ра) = 21,15×1,43+40 = 30 + 40 = 70 г;
w2(H2SO4) =  × 100% =
× 100% = 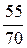 × 100% = 78,6%/
× 100% = 78,6%/
Ответ: 78,6%.
Упражнения и задачи для самостоятельного решения
1. С какими из оксидов: Na2O, SO3, CO2, ZnO могут взаимодействовать: а) азотная кислота; б) гидроксид калия. Составьте уравнения реакций, назовите вещества.
2. Определите степень окисления кислотообразующего элемента, составьте графические формулы и назовите следующие кислоты: H2CrO4, H2Cr2O7, HMnO4, HClO2, HClO4.
3. Оксид кальция массой 14 г обработали раствором, содержащим 35 г азотной кислоты. Какая масса соли образуется? (Ответ: 41 г).
4. На растворение 8 г оксида меди(II) затратили 200 г раствора серной кислоты. Рассчитайте массовую долю серной кислоты в исходном растворе. (Ответ: 4,9%)
5. Какая масса цинка может прореагировать с соляной кислотой объемом 50 мл (пл. 1,14 мл) и массовой долей соляной кислоты 0,2? Какой объем водорода (н.у.) выделится? (Ответ: 9,8 г; 3,4 л)
6. Какая масса соли образуется при смешивании 40 мл раствора азотной кислоты (пл.=1,12 г/мл) с массовой долей кислоты 0,2 и 35 мл раствора гидроксида натрия (пл.=1,17 г/мл) с массовой долей гидроксида 0,15? (Ответ: 12,1 г)
7. С какими из веществ будет реагировать соляная кислота: Ag, CuO, Mg, Ca(OH)2, K2CO3, AlCl3, SiO2? Составьте уравнения возможных реакций в молекулярном и сокращенном ионном виде.
 Дополнительные задания
Дополнительные задания
1. В растворе массой 150 г, содержащем смесь соляной и азотной кислот, растворяется максимально 24 г оксида меди(II). После упаривания раствора и прокаливания осадка масса его составляет 29,5 г. Определите массовые доли соляной и азотной кислот в исходном растворе.
(Ответ: 25,2% HNO3; 7,3% HCl)
2. При растворении 27,2 г смеси железа и оксида железа(II) в серной кислоте и выпаривании раствора досуха образовалось 111,2 железного купороса – гептагидрата сульфата железа(II). Определите массы веществ в исходной смеси. (Ответ: 5,6 г Fe; 21,6 г FeO)
3. При растворении оксида азота(IV) в воде в присутствии кислорода образовалась кислота, для нейтрализации которой потребовалось 3,2 г гидроксида натрия. Установите объем (н.у.) оксида азота(IV).
(Ответ: 1792 мл)
4. В какой массе раствора с массовой долей Н2SO4 32% следует растворить 40 г оксида серы(VI), чтобы получить раствор с массовой долей кислоты 50%? (Ответ: 161 г)
5. К 242,9 г раствора с w(Н3РО4) = 8% добавили 7,1 г Р2О5 и раствор прокипятили. Вычислите массовую долю вещества в полученном растворе. (Ответ: 11,7%)
6. 20 г смеси медных и алюминиевых опилок обработали избытком соляной кислоты. При этом выделилось 16,8 л газа (н.у.). Определите массовые доли металлов в смеси. (Ответ: 32,5%; 67,5%)
Поиск по сайту: