 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Тест тапсырмалары 19 страница
À+Â=ÀÂ
Áiðàқ áұë ðåàêöèÿ өòå áàÿó æүðåòiíäiêòåí æүéåгå êàòàëèçàòîð (Ê) қîñàäû. Êàòàëèçàòîð ðåàêöèÿғà қàòûñàòûí çàòòûң áiðåóiìåí òұðàқñûç àðàëûқ қîñûëûñ òүçåäi:
Â+Ê=ÂÊ
Òүçiëãåí ÂÊ қîñûëûñû ðåàêöèÿғà қàòûñàòûí çàòòûң åêiíøiñiìåí өòå òåç әðåêåòòåñiï, íåãiçãi çàòòû òүçåäi äå, êàòàëèçàòîð бос күйінде áөëiíiï øûғàäû:
À+ÂÊ=ÀÂ+Ê
Áұë òåңäåó êàòàëèçàòîðдың ðåàêöèÿ íәòèæåñiíäå шыққан çàòòûң құðàìûíà êiðìåéòiíií êөðñåòåäi.
Ãåòåðîãåíäiê êàòàëèçäå êàòàëèçàòîð ìåí ðåàêöèÿëàñóøû çàòòàðäûң æàíàñó áåòiíiң ìàңûçû өòå çîð. Ìûñàëû, ұíòàқ òүðiíäå àëûíғàí ïëàòèíà ñàëìàғû áiðäåé êåñåê ïëàòèíàғà қàðàғàíäà ðåàêöèÿ æûëäàìäûғûí æүçäåãåí åñå àðòòûðàäû. Ñîíäûқòàí қàòàëèçàòîðäûң æàíàñó áåòií, ÿғíè ðåàêöèÿ æүðåòií жанасу áåòií үëêåéòó үøií êàòàëèçàòîðäû êåñåê êүéiíäå қîëäàíáàéäû, îíû ұíòàқòàï êåóåê çàòòûң áåòiíå æàïñûðó àðқûëû қîëäàíàäû.
Әäåòòå, әðåêåòòåñóøi æүéåãå ñәóëåмен әñåð åòêåí êåçäå, ìîëåêóëàäàғû êîâàëåíòòi áàéëàíûñòûң үçiëói орын алады:
Cl2 + hn = Cl• + Cl•
Байланыстың үзілуі нәтижесінде хëîð ìîëåêóëàñû ûäûðàï, әð õëîð атомында äàðà ýëåêòðîí ïàéäà áîëàäû. Äàðà ýëåêòðîíû áàð атомды немесе ìîëåêóëàíû áîñ ðàäèêàë äåп атайды. Áîñ ðàäèêàëäàð æåêå êүéінäå êөï “өìið ñүðå” àëìàéäû. Ñîíäûқòàí áîñ ðàäèêàëäàð қатысуымен жүретін ðåàêöèÿлар îðàñàí çîð æûëäàìäûқïåí, êåéäå қîïàðûëûñ áåðå æүðåäi. Îëàðäûң àêòèâòåó ýíåðãèÿñû өòå òөìåí болады (0-40 êÄæ/ìîëü). Áîñ ðàäèêàëäàð àðàñûíäàғû ðåàêöèÿ òiçáåêòi ðåàêöèÿ ìåõàíèçìiìåí æүðåäi. Îñû òүçiëãåí ðàäèêàëäàð ñóòåê ìîëåêóëàñûìåí äå өòå îңàé әðåêåòòåñåäi:
Cl• + Í2= ÍCl + Í•
Пайда болған сóòåê ðàäèêàëû õëîð ìîëåêóëàñûìåí әðåêåòòåñåäi. Áұë ðåàêöèÿ îñûëàé æүðå áåðåäi. Ìұíäàé òiçáåêòiң үçiëói, ðàäèêàëäàðäûң ûäûñ қàáûðғàñûíà ñîғûëóû íåìåñå ðàäèêàëäàðäûң өçàðà әðåêåòòåñуі нәтижесінде òîқòàéäû.
Õèìèÿëûқ ðåàêöèÿëàðäû æûëäàìäàòóäûң ôèçèêàëûқ әäiñòåði. Ãåòåðîãåíäi õèìèÿëûқ ðåàêöèÿëàðäûң æûëäàìäûғû
Ãåòåðîãåíäiê õèìèÿëûқ ðåàêöèÿëàðäà әðåêåòòåñóøi çàòòàð әð òүðëi àãðåãàòòûқ êүéäå áîëàäû, õèìèÿëûқ үрдіс êөáiíåñå қàòòû çàòòûң áåòiíäå æүðåäi. Ãåòåðîãåíäiê ðåàêöèÿëàðäûң æàëïû æûëäàìäûғû îíû құðàéòûí æåêå үрдістерäiң æûëäàìäûғûíà áàéëàíûñòû áîëàäû. Êөп жағдайда қàòòû çàòòûң áåòiíäå æүðåòií íåãiçãi õèìèÿëûқ үрдіс òåç æүðåäi äå, àë ñîë ðåàêöèÿғà қàòûñàòûí çàòòàðäûң таралуы, ÿғíè äèôôóçèÿ құбылысы áàÿó æүðåäi. Ñîíäûқòàí êөïòåãåí ãåòåðîãåíäiê ðåàêöèÿëàðäûң æûëäàìäûғû äèôôóçèÿ үрдіñiíå áàéëàíûñòû áîëàäû.
Àë åíäi қàòòû çàòòûң áåòiíäå жүретін õèìèÿëûқ үрдісòiң æûëäàìäûғû әðåêåòòåñåòií çàòòàðäûң òàáèғàòûíà, òåìïåðàòóðàғà, қàòòû çàò áåòiíiң ауданына, ãàç æәíå ñұéûқ çàòòàðäûң êîíöåíòðàöèÿëàðûíà áàéëàíûñòû áîëàäû. Áiðàқ қàòòû çàòòûң êîíöåíòðàöèÿñûíà áàéëàíûñòû áîëìàéäû.
Ãåòåðîãåíäiê ðåàêöèÿëàðäûң æûëäàìäûғû çàòòàðäûң æiêòåëó æûëäàìäûғûìåí àíûқòàëàäû. Ìûñàëû, àêòèâòåó ýíåðãèÿñû æîғàðû êөìiðäiң æàíó ðåàêöèÿñûíûң æûëäàìäûғû îòòåêòi òåç æåòêiçiï îòûðñà өòå æîғàðûëàéäû. Áiðàқ îñûíäàé үрдісòåð áàðëûқ æàғäàéëàðäà áîëà бермейді. Òåìiðäiң òîòûғó ïðîöåñi îòòåêòi æåòêiçãåíãå áàéëàíûñòû åìåñ.
Ðåàêöèÿ æûëäàìäûғûí àíûқòàéòûí реакцияның ñàòûсы ëèìèòòiê ñàòû äåï àòàëàäû.
Ãåòåðîãåíäiê ðåàêöèÿëàð ãîìîãåíäiê ðåàêöèÿëàðғà қàðàғàíäà êåø àÿқòàëàäû. Ñîíäûқòàí îñû ðåàêöèÿëàðäû æûëäàìäàòó үøií ãåòåðîãåíäiê ðåàêöèÿëàð ìåõàíèçìií ãîìîãåíäiê ðåàêöèÿëàðäûң ìåõàíèçìiíå æàқûíäàòóғà òûðûñàäû. Îë үøií ãåòåðîãåíäiê ðåàêöèÿíûң áàñûíäà әðåêåòòåñåòií çàòòàðäû ìàêñèìàëäû àðàëàñòûðûï ãîìîãåíäiê êүéãå æåòêiçåäi.
4. Бақылау сұрақтары:
1.Қай зат бірінші жанады: ағаш тақтай ма немесе ағаштың ұнтағы ма?
2.Қай жерде көмір үлкен жылдамдықпен жанады: ауада немесе оттекте?
3.Химиялық реакцияның жылдамдығын қалай анықтайды?
4.Қандай жағдайлар химиялық реакцияның жылдамдығына әсер етеді?
5. Тест тапсырмалары:
1. Химиялық кинетика дегеніміз не?
1) химиялық реакцияның жүру мүмкіндігін қарастыратын химияның бір тарауы
2) химиялық реакцияның жылу эффектісін зерттейтін ілім
3) химиялық заттардың бір-біріне айналуын қарастыратын химияның бір бөлімі
4) химиялық заттардың құрылысын зерттейтін жаратылыстану ғылымы
5) химиялық реакцияның механизмі мен жылдамдығын зерттейтін химияның бір саласы
2.Химиялық реакция жылдамдығына анықтамасы:
1) белгілі бір уақыт ішінде реакцияласушы заттардың көлемінің өзгерісі
2) реакцияласушы заттардың жанасу бетінде реакцияның жүру қарқыны
3) жылдамдыққа әсер етуші факторларға химиялық реакцияның тәуелділігі
4) жылдамдықтың температураға, қысымға тәуелділігі
5) реакция жүретін кеңістіктің бірлігінде (белгілі көлемінде немесе фазалар бөлігінің беттік ауданында) белгілі бір уақыт аралығында реакцияласушы заттардың мөлшерінің өзгерісі
3. Гомогенді реакцияны көрсетіңіз:
1) СаО + СО2 → СаСО3
2) N2 + О2 ↔ 2NО
3) СаСО3 → СаО + СО2
4) СаО + Н2О → Са(ОН)2
5) 2Сu + О2 → 2СuО
4. Қай реакция гетерогенді реакцияға жатады?
1) N2 + 3Н2 ↔ 2NН3
2) N2 + О2 ↔ 2NО
3) 2Nа + 2НОН → 2NаОН + Н2
4) 2NаОН + НСl → NаСl + НОН
5) Fe + S → FeS
5. Гомогенді реакцияның жылдамдығы қай формуламен анықталады?
1) 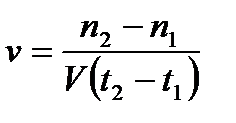
2) 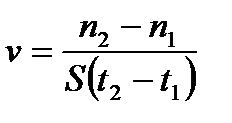
3) 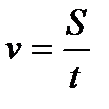
4) 
5) 
6. Гетерогенді реакцияның жылдамдығы қандай формуламен өрнектейді?
1) 
2) 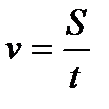
3) 
4) 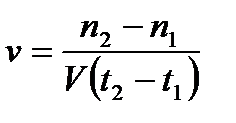
5) 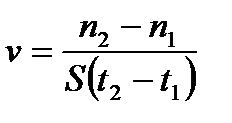
7. Реакцияға қатысушы заттар мен реакция өнімдерінің саны мен құрамына байланысты реакциялар қанша (және қандай) түрге бөлінеді?
1) екі (гомогенді, гетерогенді)
2) төрт (қосылу, айрылу, тотығу, алмасу)
3) төрт (қосылу, айрылу, орынбасу, алмасу)
4) екі (электрондардың алмасуы арқылы жүретін, электрондардың алмаспауы арқылы жүретін)
5) төрт (тотығу-тотықсыздану, экзотермиялық, эндотермиялық, каталитикалық)
8. Реакцияның орташа жылдамдығы қандай формуламен анықталады?
1) 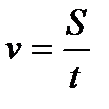
2) 
3) 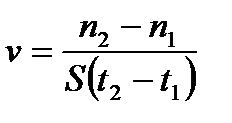
4) 
5) 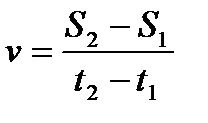
9. Берілген 2NO (г) + О2 (г) = 2NO2 реакцияның жылдамдығы қалай өзгереді, егер жүйенің қысымы 3 есе азайса?
1) 6 есе кемиді
2) 18 есе кемиді
3) 27 есе кемиді
4) 27 есе артады
5) 18 есе артады
10. Берілген 2NO (г) + О2 (г) = 2NO2 реакцияның жылдамдығы қалай өзгереді, егер әрекеттесуші заттардың концентрациясы 2 есе көбейсе?
1) 4 есе артады
2) 18 есе кемиді
3) 6 есе кемиді
4) 8 есе артады
5) 10 есе артады
11. Берілген 2NO (г) + О2 (г) = 2NO2 реакцияда оттектің концентрациясын 3 есе арттырғанда реакция жылдамдығы қалай өзгереді?
1) 8 есе артады
2) 6 есе кемиді
3) 3 есе кемиді
4) 6 есе артады
5) 3 есе артады
12. Катализатордың химиялық реакциядағы ролі қандай?
1) реакция жылдамдығын кемітеді
2) реакция жылдамдығын арттырады, әрі реакция өнімінің құрамында болады
3) реакция жылдамдығын арттырып өзі ыдырап кетеді
4) реакция жылдамдығына әсер етпейді
5) реакция жылдамдығын арттырады, бірақ өзі реакция аяғында өзгеріссіз қалады
13. Қандай зат ингибитор деп аталады?
1) реакция жылдамдығын арттыратын
2) реакция жылдамдығын кемітетін
3) реакция жылдамдығына әсер етпейтін
4) жылдамдықты бірде арттырып, бірде кемітетін
5) реакция жылдамдығын алдымен арттырып, одан кейін әсер етпейтін
14. Катализ дегеніміз не?
1) реакция механизмі
2) реакция жылдамдығын арттыратын зат
3) реакция жылдамдығына әсер ететін заттар
4) гомогенді және гетерогенді реакциялар
5) катализатор қатысуында реакция жылдамдығының арту құбылысы
15. Температураның реакция жылдамдығына әсері қандай теңдеумен өрнектеледі?
1) 
2) 
3) 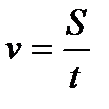
4) 
5) 
16. Температураны 200С –қа көтергенде температуралық коэффициенті 3-ке тең болатын реакцияның жылдамдығы неше есе артады?
1) 3 есе
2) 6 есе
3) 27 есе
4) 9 есе
5) 2 есе
17. С + О2 = CO2 реакциясы үшін кинетикалық теңдеу жазыңыз:
1) υ = k[O]2
2) υ = k[O2][C]
3) υ = k[СO2]
4) υ = k[O2]
5) υ = k[O2] [C] /[СO2]
18. С + О2 = CO2 реакциясы үшін әрекеттесуші массалар заңының математикалық өрнегін көрсетіңіз:
1) υ = k[СO2]
2) υ = k[O]2
3) υ = k[O2]
4) υ = k[O2][C]
5) υ = k[O2][C] /[СO2]
19. Берілген 2Н2 + О2 = 2Н2O тура бағытта жүретін реакцияның жылдамдығын қандай формуламен өрнектейді?
1) υ = k[O2][H2]
2) υ = k[O2] [H2]2
3) k[O2][H2]2 / [Н2O]2
4) υ = k[H2O]2
5) υ = k[O2]
20. Пайдалы соқтығысулар үлесін анықтайтын формула:
1) 
2) 
3) 
4) 
5) 
21. Вант-Гофф ережесінің математикалық өрнегі:
1) 
2) 
3) 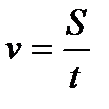
4) 
5) 
22. Гетерогенді катализ:
1) 2SO2 + O2  2SO3
2SO3
2) 2CO + O2  2CO2
2CO2
3) 2SO2 + O2  2SO3
2SO3
4) NaOH + HCl = NaCl + HOH
5) КОН + НNO3 = KNO3 + H2O
23. Zn + 2HCl = ZnCl2 + H2 реакциясы үшін әсер етуші массалар заңы қалай өрнектеледі?
Поиск по сайту: