 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЛЕКЦИЯ 16. ОСНОВНЫЕ ПОНЯТИЯ КВАНТОВОЙ
МЕХАНИКИ
Корпускулярно-волновой дуализм
Гипотеза де Бройля. Дифракция электронов
Основные понятия квантовой механики
Теория Бора оказалась недостаточной для объяснения многих явлений микромира - строения многоэлектронных атомов, молекул, химической связи и т.д. Идеи де Бройля и выявленные на опыте волновые свойства частиц вещества послужили толчком к созданию принципиально новой теории, описывающей поведение микрочастиц с учетом их волновых свойств. Этой теорией стала квантовая (волновая) механика, основы которой были созданы в 1925—1926 гг. В.Гейзенбергом и Э.Шредингером. Квантовая механика раскрывает два основных свойства вещества: квантованность внутриатомных процессов и волновую природу частиц. Квантовая механика лишена наглядности, характерной для классической механики. Образы привычного нам макромира становятся непригодными для описания явлений, происходящих в микромире. При изучении явлений, происходящих в макромире, мы пользовались законами классической физики, которые остаются незыблемыми, если ограничить область их применения. Для того чтобы решить вопрос о том, какими законами механики (классическими или релятивистскими) следует пользоваться для описания рассматриваемого явления, нужно знать, с какой скоростью движется исследуемый объект. Если его скорость соизмерима со скоростью света в вакууме, то нужно применять релятивистские формулы. Скорость света в вакууме является критерием, определяющим границу применимости классических законов, так как она является максимальной скоростью передачи сигналов.
Возникает вопрос: существует ли подобный критерий при описании поведения мельчайших частиц вещества, обладающих корпускулярно-волновым дуализмом? Да, такой критерий существует, им является постоянная Планка.
Для того чтобы описать поведение любой частицы, нужно определить ее координату x, импульс p, энергию Е и т.д. В классической физике нет каких-либо ограничений, запрещающих с любой степенью точности одновременно измерить, например, координату х и соответствую-щую проекцию импульса рх. В квантовой механике положение принципиально иное. Так как движущаяся частица обладает корпускулярно-волновым дуализмом, то одновременное точное определение координаты х и импульса рх невозможно.
Тщательный анализ поведения микроскопических частиц, проведенный Гейзенбергом, показал, что существует принципиальный предел точности измерений указанных величин. Если обозначить Δх, Δу, Δz не точность (неопределенность) определения координаты, а Δрх Δру, Δрz, - неточность (неопределенность) определений соответствующих проекций импульса, то эти величины между собой связаны зависимостями:
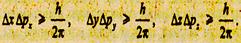 (16.1)
(16.1)
Эту зависимость называют соотношением неопределенностей Гейзенберга. Из него следует: чем точнее определена координата (Δx→0), тем менее точно определен импульс (Δрх→0), и наоборот.
Таким образом, соотношение неопределенностей устанавливает пределы, за которыми принципы классической физики становятся неприемлемыми. Если произведение ΔхΔр сравнимо с h, то поведение частицы описывается законами квантовой механики, если ΔхΔр велико по сравнению с h, то поведение частицы описывается законами классической физики. Чтобы понять, почему эксперимент не дает большей точности, чем позволяют соотношения неопределенности, предположим, что необходимо точно определить положение электрона, летящего в пучке со скоростью v, импульсом p (рис, 16.1). На пути пучка находится щель АВ шириной α. За щелью находится экран CD, на котором наблюдается дифракционная картина (ширина щели α сравнима с длиной волны де Бройля λ для электронов). Пунктирной линией изображена плотность вероятности для центрального максимума. При дифракции от одной щели интенсивностью максимумов высшего порядка можно пренебречь по сравнению с интенсивностью центрального максимума.
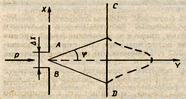
Рис. 16.1
Положение центрального максимума определяется направлением на минимумы первого порядка, т е. углом φ, определяемым из соотношения?
sinφ = 2k λ/2, где k = 1, откуда sinφ=λ/α
где, λ = h/(mv) = h/p (16.2)
Так как каждый электрон до щели движется в пучке перпендикулярно плоскости щели, то составляющая импульса рx = 0, но координата х электрона неопределенная. В момент прохождения щели электрон имеет координату, равную координате щели. В определении координаты электрона содержится неопределенность, зависящая от размеров щели: Δx = α. При дифракции появляется составляющая импульса рx, неопределенность составляющей импульса зависит от угла φ:
Δ рx = р sinφ. (16.3)
Учитывая (16.2), получаем
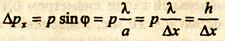 Δх Δрx = h. (16.4)
Δх Δрx = h. (16.4)
Если учесть наличие второго дифракционного максимума, то неопределенность в определении импульса увеличивается, поэтому выражение можно переписать в виде:
Δх Δрx ≥ h. (16.5)
Соотношение, аналогичное (16.5), имеет место для времени и энергии:
ΔE Δt ≥ h. (16.6)
Рассмотрим это соотношение в применении к возбужденному состоянию атома. Если считать Δt средним временем жизни возбужденного состояния атома, а ΔЕ - средней шириной его энергетического уровня (ценность энергии состояния), то, чем короче время существования какого-либо состояния системы, тем более неопределенно значение его энергии. При переходе атома из возбужденного в нормальное состояние излучается квант энергии, характеризуемый некоторой частотой размытости Δν=ΔЕ/h спектральной линии излучения, что приводит к расширению спектральных линий.
Следует отметить, что волны де Бройля не являются электромагнитными. Они имеют особую природу, не имеющую аналогии в классической физике. Причем волны де Бройля представляют собой универсальное явление для всех движущихся частиц. Гипотеза де Бройля экспериментально подтвердилась в опытах К. Дэвиссона и Л. Джермера в 1927 году, наблюдавших рассеяние электронов монокристаллом никеля.
Электронная пушка испускала пучок электронов определенней скорости, которые попадали на монокристалл никеля и рассеивались им. Приемником рассеянных электронов служил цилиндр Фарадея, число электронов, попадавших в цилиндр Фарадея, было пропорционально силе тока в электрической цепи цилиндра. С точки зрения классической физики электроны рассеивались бы под всевозможными углами. Однако при наблюдении рассеяния электронов под углами 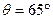 оказалось, что максимум числа отраженных электронов (максимум силы тока) в электрической цепи приходился на электроны с энергией Е = 54 эВ, что соответствовало волне Де Бройля
оказалось, что максимум числа отраженных электронов (максимум силы тока) в электрической цепи приходился на электроны с энергией Е = 54 эВ, что соответствовало волне Де Бройля 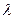 = 0,167 нм. Рассеяние электронов происходило подобно рассеянию рентгеновских лучей при выполнении условия Вульфа-Брэгга:
= 0,167 нм. Рассеяние электронов происходило подобно рассеянию рентгеновских лучей при выполнении условия Вульфа-Брэгга:
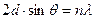 . (16.7)
. (16.7)
Таким образом, опыты Дэвиссона и Джермера подтвердили гипотезу де Бройля о существовании волновых свойств у электронов. Позднее волновые свойства электронов были подтверждены другими независимыми опытами.
В экспериментах по рассеянию электронов на кристаллах, как было показано выше, обнаруживается, что в отдельных направлениях рассеивается большее число электронов, чем во всех других. С волновой точки зрения наличие максимумов числа электронов в некоторых направлениях означает, что в этих направлениях волны де Бройля имеют наибольшую интенсивность. Учитывая, что интенсивность волны пропорциональна квадрату модуля амплитуды волны, можно дать своеобразное вероятностное толкование волн де Бройля. Квадрат модуля амплитуды ½А½2 волн де Бройля в данной точке пространства является мерой вероятности того, что частица находится в этой точке.
Для описания распределения вероятности нахождения частицы в данный момент времени в некоторой области пространства вводится функция координат и времени, которую называют волновой функцией  . Волновая функция
. Волновая функция  сама по себе физического смысла не имеет, смысл имеет квадрат модуля волновой функции. Определим его следующим образом: вероятность
сама по себе физического смысла не имеет, смысл имеет квадрат модуля волновой функции. Определим его следующим образом: вероятность 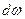 того, что частица находится в элементе объема
того, что частица находится в элементе объема 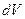 , пропорциональна квадрату модуля волновой функции ½
, пропорциональна квадрату модуля волновой функции ½ 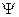 ½2 и элементу объема
½2 и элементу объема 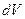 , т.е.
, т.е.
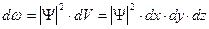 . (16.8)
. (16.8)
Плотность вероятности будет равна
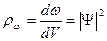 (16.9)
(16.9)
Она определяет вероятность пребывания частицы в данной точке пространства. Следовательно, квадрат модуля волновой функции, где 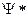 комплексно сопряженная с
комплексно сопряженная с 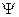 волновая функция, представляет собой вероятность нахождения частицы в данной точке пространства. Иными словами, величина
волновая функция, представляет собой вероятность нахождения частицы в данной точке пространства. Иными словами, величина 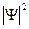 определяет интенсивность волн де Бройля. По определению волновой функции она должна удовлетворять следующему условию:
определяет интенсивность волн де Бройля. По определению волновой функции она должна удовлетворять следующему условию:
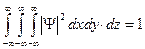 , (16.10)
, (16.10)
где тройной интеграл вычисляется по всему пространству от -¥ до ¥. Выражение означает, что нахождение частицы в какой - либо точке всего бесконечного пространства есть достоверное событие и его вероятность должна быть равна единице. Выражение называют также условием нормировки волновой функции или условием нормировки вероятностей.
Поиск по сайту: