 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
XV. 3. Дифузійна перенапруга
|
Читайте также: |
Дифузійною перенапругою ηД, як вже відмічалося вище, називається відхилення потенціалу електрода під струмом від його рівноважного значення, зумовлене сповільненістю стадії транспортування учасників електродної реакції.
Теорію дифузійної перенапруги доцільно розглядати на прикладі системи:
М│ Мz+, c│M, (a)
протікання струму через яку веде до виникнення процесів Mz+ + z ē → M (на катоді), M → Mz+ + z ē ‘ (на аноді) і зміни концентрації іонів Mz+ в приелектродних шарах електроліту. Ця зміна пов’язана з відставанням швидкості транспортування потенціалвизначаючих речовин від швидкості електродного процесу, що спостерігається до встановлення стаціонарного стану. При пропусканні струму на катоді йде розряд катіонів Mz+ із незмінною швидкістю wК, яка обумовлена заданою густиною струму і їх концентрація біля електрода зменшується. Транспорт катіонів до катоду здійснюється міграцією, швидкість якої υМ в даному електричному колі постійна, і дифузією, швидкість якої υД на протязі часу змінюється. Спочатку вона буде малою, оскільки різниця між концентрацією іонів в об’ємі електроліту дуже мала. При цьому υД << wК. Протягом часу концентрація катіонів біля електрода зменшується (за рахунок електродного процесу), а швидкість дифузії зростає. При досягненні стаціонарного стану швидкість транспортування іонів до електрода і швидкість їх розряду стають однаковими, проте концентрація їх біля катоду ск буде меншою, ніж в об’ємі електроліту. Аналогічно можна показати, що при пропусканні струму через систему (а) концентрація Mz+ біля аноду підвищується в порівнянні з їх концентрацією в об’ємі розчину. Таким чином, під струмом система (а) перейде в новий стан (б), в якому са > с > ск:

 (+) М│са Мz+, c ck │ M (-) (б)
(+) М│са Мz+, c ck │ M (-) (б)
Перехід до більш високих значень густини струму при досягненні стаціонарного стану в системі буде супроводжуватись зниженням ck і зростанням са. Через те, що при протіканні струму змінюється концентрація потенціалвизначаючих іонів біля електродів, то у відповідності з рівнянням:
 (ХV.3.1)
(ХV.3.1)
(активність у цьому рівнянні замінена концентрацією) потенціал катода стає більш негативним, а потенціал анода – більш позитивним, ніж рівноважний потенціал. Шар електроліту біля електрода, в якому за рахунок протікання струму концентрація потенціалвизначаючої речовини відрізняється від концентрації його в об’ємі розчину, називається дифузійним і має товщину 10-2 – 10-3 см.
Після того, як встановиться стаціонарний стан, концентрація іонів, що розряджаються в дифузійному шарі, змінюється лінійно і відповідно градієнт концентрації вздовж напрямку дифузії зберігає стале значення. Швидкість катодного процесу wк визначається сумою швидкості міграції Vм і швидкості дифузії VD іонів.
 (ХV.3.2)
(ХV.3.2)
А з рівняння (ХV.I.5) швидкість катодного процесу буде
 (ХV.3.3)
(ХV.3.3)
Швидкість міграції іонів складає деяку частину від швидкості катодного процесу, що відповідає числу перенесення t потенціалвизначаючих іонів:
 (ХV.3.4)
(ХV.3.4)
Диференційне рівняння дифузії:
 (ХV.3.5)
(ХV.3.5)
при площі електроду, рівній одиниці, можна записати
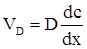 , (ХV.3.6)
, (ХV.3.6)
де D – коефіцієнт дифузії іонів;  - градієнт концентрації. В застосуванні до процесу дифузії катіонів до катода рівняння (ХV.3.6) набуде такого вигляду:
- градієнт концентрації. В застосуванні до процесу дифузії катіонів до катода рівняння (ХV.3.6) набуде такого вигляду:
 , (ХV.3.7)
, (ХV.3.7)
де δ – товщина дифузійного шару. Підставляючи в рівняння (ХV.3.2) значення wк, Vм і Vд, отримаємо
 (ХV.3.8)
(ХV.3.8)
Звідси концентрація потенціалвизначаючих іонів ск при густині струму J буде
 , (ХV.3.9)
, (ХV.3.9)
де  . (ХV.3.10)
. (ХV.3.10)
Підстановка значення ск в (ХV.3.1) дає
 (ХV.3.11)
(ХV.3.11)
Величина дифузійної перенапруги катодного процесу випливає з рівнянь (ХV.3.11) і (ХV.3.1):
 (ХV.3.12)
(ХV.3.12)
Для анодного процесу:
 , (ХV.3.13)
, (ХV.3.13)

 (ХV.3.14)
(ХV.3.14)
Аналіз рівнянь (ХV.3.12) і (ХV.3.14) з урахуванням величин, що позначені через К, показує, що дифузійна перенапруга зростає зі збільшенням густини струму і з зменшенням загальної концентрації іонів у розчині.
Розглянемо рис. 85. На ньому приведена типова крива катодної поляризації, що описує швидкість відновлення катіона в залежності від потенціалу. Лінія аа обмежує приблизно область електрохімічної кінетики, де панує звичайна експоненціальна залежність jk i – Δε (що буде розглянуто далі). Лінія bb обмежує область чисто дифузійної кінетики. Між лініями аа і bb знаходиться область змішаної кінетики, в якій швидкість електродної реакції і швидкість дифузії співмірні. Чисто електрохімічна або чисто дифузійна кінетики мають місце лише в граничних випадках значної нерівності швидкостей цих процесів.
Як видно з цього рисунку, при малих відхиленнях потенціалу від рівноважного процес підкоряється електрохімічній кінетиці. При подальшому підвищенні катодної поляризації швидкість реакції зростає і дифузія починає гальмувати її, оскільки зменшується подача достатнього числа іонів до поверхні електрода в одиницю часу. Це гальмування виявляється все більш сильно в міру збільшення катодної поляризації а, значить, швидкість електродної реакції все більш обмежується дифузією. Внаслідок чого настає умова граничного струму jг(к), коли швидкість дифузії вже досягла найбільш можливого значення. Тут крива йде паралельно вісі абсцис, що вказує на неможливість змінити швидкість реакції, збільшуючи поляризацію. За цих умов  .
.
Таким чином, граничний струм характеризує максимальну швидкість електродного процесу в даних умовах. При ск = 0 з рівняння (ХV.3.8) випливає
 (ХV.3.15)
(ХV.3.15)
Якщо в розчині електроліту поряд з потенціалвизначаючими катіонами у великому надлишку містяться індиферентні солі, іони яких не беруть участі в електродних процесах, але переносять електрику (солі лужних металів, амонію), то міграцією потенціалвизначаючих іонів можна знехтувати. Гранична густина струму в цих умовах називається дифузійною:
 (ХV.3.16)
(ХV.3.16)
Виникнення граничного дифузійного струму спостерігається і тоді, коли в електродній реакції беруть участь неіонізовані молекули, які транспортуються до електроліту дифузією.
Залежність дифузійної перенапруги від густини струму може бути виражена з урахуванням граничної густини струму. Поєднання рівнянь (ХV.3.10), (ХV.3.12), (ХV.3.14) і (ХV.3.15) дає
 , (ХV.3.17)
, (ХV.3.17)
 . (ХV.3.18)
. (ХV.3.18)
Величина граничного струму має важливе практичне значення. Ця величина для конкретних електрохімічних процесів дозволяє визначити умови їх проведення, що забезпечує високий вихід за струмом і необхідну якість продукту. Наприклад, електроліз водних розчинів солей міді, нікелю й інших металів при густині струму нижчої jг супроводжується утворенням компактних катодних металевих осадів, а при густині струму вище jг виділення металу – порошкоподібних. У залежності від вимог до якості продукту вибирають умови електролізу з урахуванням значення jг. Суттєву роль закони дифузійної кінетики і граничний струм відіграють в полярографії.
Полярографічний метод, що запропонований чеським вченим Гейровським (1922), полягає в проведенні електролізу досліджуваних розчинів в електролітичній ячейці, одним із електродів якої слугує крапельний ртутний електрод. Останній може бути як катодом, так і анодом.
Крапельний ртутний електрод – це скляний капіляр, через який під тиском ртутного стовпа повільно витікає ртуть. Ртутні краплі, що утворюються на кінці капіляра через рівні проміжки часу (зазвичай в межах 0,2¸6 с), відриваються від капіляра і падають на дно посудини. Кожна ртутна крапля до моменту її відривання слугує електродом. Допоміжним електродом, зазвичай, застосовують ртутний електрод з великою поверхнею, потенціал якого практично не змінюється при проходженні струму невеликої густини. В досліджуваний розчин добавляють достатній надлишок індиферентного електроліта, який забезпечує високу електропровідність розчину. Таким чином, зміна прикладеної ззовні різниці потенціалів при виконанні вимірювань буде відповідати зміні крапельного електрода.
При поступовому збільшенні зовнішньої різниці потенціалів на вказаних електродах спочатку весь струм йде на зарядку електрода (подвійного електричного шару), тому сила струму в колі залишається безмежно малою, що вказує на відсутність електрохімічного процесу (рис. 86).
Після досягнення певної різниці потенціалів (точка а) відбувається різке збільшення сили поляризуючого струму, що вказує на початок електрохімічного процесу електровідновлення або електроокиснення. В міру  того, як потенціал електрода і сила струму збільшуються, концентрація частинок, що відновлюються або окиснюються біля поверхні, зменшується і наступає дифузійна поляризація. В решті-решт, при збільшенні поляризації концентрація частинок біля поверхні електрода падає до нуля і струм досягає свого граничного значення (точка b). Таким чином, поляризаційна крива має вигляд своєрідної хвилі. Така крива називається полярографічною кривою або полярограмою. Початок хвилі відповідає початку реакції окиснення або відновлення, а висота хвилі, що визначається величиною граничного струму, характеризує дифузію речовини до електрода. В наслідок того, що швидкість дифузії пропорційна концентрації, висота хвилі безпосередньо зв’язана з концентрацією реагуючих частинок. Це дозволяє використати полярографічний метод для кількісного аналізу складних електролітів. Потенціал, при якому величина струму досягає половини граничного струму дифузії
того, як потенціал електрода і сила струму збільшуються, концентрація частинок, що відновлюються або окиснюються біля поверхні, зменшується і наступає дифузійна поляризація. В решті-решт, при збільшенні поляризації концентрація частинок біля поверхні електрода падає до нуля і струм досягає свого граничного значення (точка b). Таким чином, поляризаційна крива має вигляд своєрідної хвилі. Така крива називається полярографічною кривою або полярограмою. Початок хвилі відповідає початку реакції окиснення або відновлення, а висота хвилі, що визначається величиною граничного струму, характеризує дифузію речовини до електрода. В наслідок того, що швидкість дифузії пропорційна концентрації, висота хвилі безпосередньо зв’язана з концентрацією реагуючих частинок. Це дозволяє використати полярографічний метод для кількісного аналізу складних електролітів. Потенціал, при якому величина струму досягає половини граничного струму дифузії  , називається потенціалом напівхвилі ε 1/2. Величина ε1/2 не залежить від концентрації іонів, що розряджаються, а визначається їх природою і середовищем, в якому протікає електродна реакція. При якісному аналізі розчину за експериментально одержаною полярограмою знаходять потенціали напівхвиль і порівнюють їх із вже відомими значеннями ε1/2 для різних іонів. В основі кількісного полярографічного аналізу лежить лінійна залежність граничного дифузійного струму від концентрації потенціалвизначаючих іонів. Для ртутного крапельного електрода граничний дифузійний струм ІД пов’язаний з концентрацією іонів, що розряджаються, рівнянням Ільковича:
, називається потенціалом напівхвилі ε 1/2. Величина ε1/2 не залежить від концентрації іонів, що розряджаються, а визначається їх природою і середовищем, в якому протікає електродна реакція. При якісному аналізі розчину за експериментально одержаною полярограмою знаходять потенціали напівхвиль і порівнюють їх із вже відомими значеннями ε1/2 для різних іонів. В основі кількісного полярографічного аналізу лежить лінійна залежність граничного дифузійного струму від концентрації потенціалвизначаючих іонів. Для ртутного крапельного електрода граничний дифузійний струм ІД пов’язаний з концентрацією іонів, що розряджаються, рівнянням Ільковича:
 (ХV.3.19)
(ХV.3.19)
де z – заряд іонів; F – стала Фарадея; Д – коефіцієнт дифузії іонів, м2·с-1; m – маса ртуті, що витікає з капіляру електрода за 1с, кг; t – період крапання, с; с – концентрація іонів у розчині, моль/м3.
За рівнянням Ільковича можна визначати число електронів z, що беруть участь в електродній реакції, коефіцієнти дифузії Д і концентрації с речовин, робити висновок про природу лімітуючої стадії та розв’язувати інші проблеми, що стосуються електрохімічної кінетики й електрохімічного аналізу.
Поиск по сайту: