 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Порядок расчета. Обозначим массу исходного раствора за Х
Обозначим массу исходного раствора за Х. Массовая доля СuSО4 в насыщенном при 100°С растворе, исходя из условия, составляет:
ω 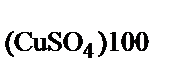 =
= 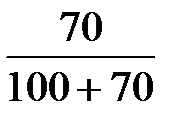 = 0,41;
= 0,41;
в маточном растворе при 20°С
ω 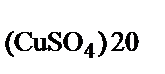 =
= 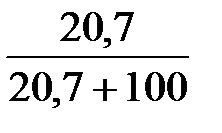 = 0,17.
= 0,17.
в кристаллогидрате
ω 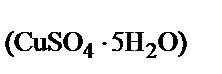 =
= 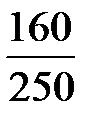 = 0,64;
= 0,64;
где 160 и 250 – молярные массы СuSО4 и СuSО4 × 5Н2О соответственно, г/моль.
Тогда, исходя из рассчитанного содержания СuSО4 во входящем и выходящих потоках, справедливо равенство
0,41 × Х = 0,64 × 1000 + (Х – 1000) × 0,17.
Откуда Х равен 1960 кг.
Тогда масса маточного раствора составит
1960 – 1000 = 960 кг.
Определяем массу соли в исходном и маточном растворах:
m 100 = 1960 × 0,41 = 803 кг;
m 20 = 960 × 0,17 = 163 кг.
На основе полученных данных составляем таблицу материального баланса процесса кристаллизации СuSО4 × 5Н2О (табл. 8).
Таблица 8
Материальный баланс процесса кристаллизации СuSО4 × 5Н2О
| Приход | Расход | ||
| Статья | кг | Статья | кг |
| Раствор СuSО4 (41%) | СuSО4 × 5Н2О | ||
| В том числе | В том числе | ||
| СuSО4 Н2О | СuSО4 Н2О | ||
| Раствор СuSО4 (17%) | |||
| В том числе СuSО4 Н2О | |||
| Итого | Итого |
Пример 5. Рассчитать расход известняка, содержащего 12% примесей, для получения 1000 м3 (н. у.) СО2, если термообработанный продукт содержит 90,5% СаО и 5,5% СаСО3. Примеси в известняке – вода и SiO2. Составить материальный баланс процесса получения негашеной извести по реакции
СаСО3 = СаО + СО2
Поиск по сайту: