 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Порядок расчета. При получении азотной кислоты протекают следующие реакции:
При получении азотной кислоты протекают следующие реакции:
1-я стадия
основная - 4NН3 + 5О2 = 4NО + 6Н2О (36)
параллельная - 4NН3 + 3О2 = 2N2 + 6Н2О (37)
2-я стадия
2NО + О2 = 2NО2
3-я стадия
2NО2 + Н2О + 0,5О2 = 2HNO3
С учетом степени превращения аммиака в оксид азота (II) для получения 100 000 т/год HNO3 необходимо
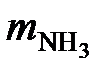 =
=  = 27 819 т/год
= 27 819 т/год
или в пересчете на часовую производительность
 = 3265 кг/ч.
= 3265 кг/ч.
Перейдем к объему NH3, для этого определим число кмоль NH3 и умножим на молярный объем
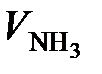 =
=  = 4302 м3/ч,
= 4302 м3/ч,
где 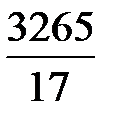 – число кмоль NH3; 22,4 – объем 1 кмоль, м3.
– число кмоль NH3; 22,4 – объем 1 кмоль, м3.
Вместе с аммиаком подается воздух, объем которого составляет
V возд = 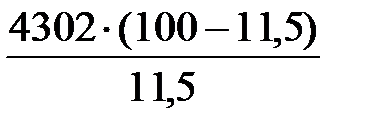 = 33 108 м3.
= 33 108 м3.
Так как для технических расчетов принимается, что содержание кислорода в воздухе составляет 21 об. %, азота – 79 об. %, то их объемный и массовый расходы равны:
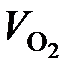 = 33 108 · 0,21 = 6953 м3/ч;
= 33 108 · 0,21 = 6953 м3/ч;
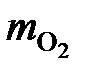 =
= 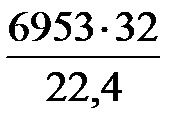 = 9933 кг/ч;
= 9933 кг/ч;
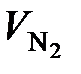 = 33 108 – 6953 = 26 155 м3/ч;
= 33 108 – 6953 = 26 155 м3/ч;
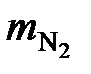 =
= 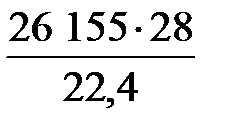 = 32 694 кг/ч.
= 32 694 кг/ч.
С учетом селективности процесса образуется NО:
V NО = 4302 · 0,97 = 4173 м3/ч;
m NO = 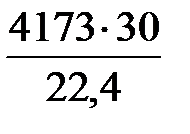 = 5589 кг/ч.
= 5589 кг/ч.
В результате протекания реакции (37) образуется N2:
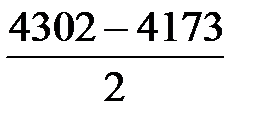 = 65 м3/ч,
= 65 м3/ч,
или
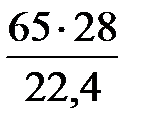 = 81 кг/ч.
= 81 кг/ч.
Объем и масса Н2О, образующейся по реакции (36), составляют:
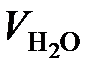 =
= 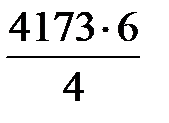 = 6260 м3/ч;
= 6260 м3/ч;
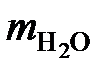 =
= 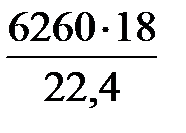 = 5030 кг/ч;
= 5030 кг/ч;
по реакции (37):
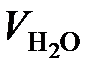 =
= 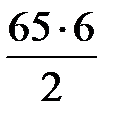 = 195 м3/ч;
= 195 м3/ч;
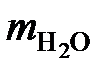 =
= 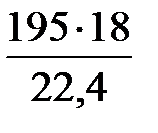 = 157 кг/ч.
= 157 кг/ч.
Суммарная масса воды равна
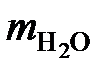 ∑ = 5030 + 157 = 5187 кг/ч.
∑ = 5030 + 157 = 5187 кг/ч.
Расходуется кислорода по реакции (36):
 =
=  = 5216 м3/ч;
= 5216 м3/ч;
по реакции (37):
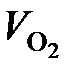 =
=  = 98 м3/ч.
= 98 м3/ч.
Объем и масса непрореагировавшего кислорода составят:
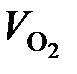 = 6953 – 5216 – 98 = 1639 м3;
= 6953 – 5216 – 98 = 1639 м3;
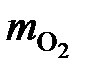 =
= 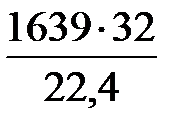 = 2341 кг.
= 2341 кг.
Образуется газ состава:
| м3 | об. % | |
| NО | 10,8 | |
| N2 | 65 + 26 155 = 26 220 | 68,1 |
| О2 | 6953 – (5216 + 98) = 1639 | 4,2 |
| Н2О | 195 + 6260 = 6455 | 16,9 |
Результаты расчетов сводим в табл. 5.
Таблица 5
Поиск по сайту: