 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Электролит – это вещество, которое при определенных условиях способно распадаться на заряженные частицы, называемые ионами.
Под определенными условиями может подразумеваться раствор, расплав, распад на ионы под действием температуры (термодиссоциация CaCO3 «CaO + CO2), в плазме и фотодиссоциация – разложение веществ под действием ионизирующего излучения (Cl2 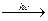 2Cl).
2Cl).
Раствор электролита – это раствор, который способен проводить электрический ток.
КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ
| Сильные Электролиты, которые полностью диссоциируют в растворе АВ®А+ + В- | Слабые Электролиты, которые не диссоциируют полностью АВ«А+ + В- |
| 1) соли (NaCl, KCl, MgSO4, CH3COONa) | 1) соли (Hg2Cl2) |
| 2) щелочи (NaOH, KOH, Ca(OH)2) | 2) основания (NH3) |
| 3) кислоты (HNO3, H2SO4, HCl, HClO4) | 3) кислоты (H2CO3, H3BO3, CH3COOH, C6H5COOH) |
| 4) органические соединения (C6H4(OH)2 (гидрохинон), C6H5NH2 (анилин)) |
Диссоциация электролитов наблюдается в полярных растворителях и зависит от их диэлектрической проницаемости e. Чем выше значение диэлектрической проницаемости, тем полнее диссоциация.
Большая диэлектрическая проницаемость наблюдается для воды (при 25 0С e=78,3). Лишь незначительное количество неводных растворов, например, формамид, имеют диэлектрическую проницаемость выше, чем у воды. Растворы электролитов в подобных растворителях обладают высокой электрической проводимостью.
В неполярных растворителях, таких как четыреххлористый углерод (e=2,238), электролитической диссоциации практически не происходит.
В зависимости от числа образующихся в результате электролитической диссоциации катионов и анионов различают симметричные и несимметричные электролиты.
ЭЛЕКТРОЛИТЫ
| Симметричные число катионов = числу анионов | Несимметричные число катионов ¹ числу анионов |
| 1) NaCl, KBr, HCl 1,1 – зарядные (одно-одно-зарядные) | 1) K2SO4, H2SO4 1,2 - зарядные |
| 2) MgSO4, ZnSO4 2,2 - зарядные (двух-двух-зарядные) | 2) MgCl2, CaBr2 2,1 - зарядные |
ТЕОРИЯ СЛАБЫХ ЭЛЕКТРОЛИТОВ.
СТЕПЕНЬ И КОНСТАНТА ДИССОЦИАЦИИ
Первая количественная теория растворов электролитов (теория электролитической диссоциации) была высказана Аррениусом. По этой теории молекулы электролитов при растворении распадаются на противоположно заряженные ионы. Процесс диссоциации слабого электролита обратим, т.е. наряду с диссоциацией молекул происходит образование молекул из ионов и, таким образом, в растворе наряду с ионами существуют и молекулы.
Доля молекул, распадающихся на ионы, оценивается степенью электролитической диссоциации, которую обычно обозначают a. Степень диссоциации – это отношение числа молекул, распавшихся на ионы, к числу молекул растворенного вещества.
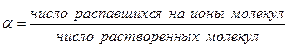
Степень диссоциации является характеристикой электролита:
Для неэлектролитов (сахароза) a = 0;
Для сильных электролитов a ≥ 1;
Для слабых электролитов 0 < a < 1.
Рассмотрим диссоциацию уксусной кислоты: СН3СООН 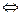 Н+ + СН3СОО-
Н+ + СН3СОО-
Так как процесс диссоциации слабого электролита обратим, то он характеризуется константой равновесия. Константа равновесия для процесса диссоциации есть константа диссоциации. Т.е. все закономерности, характерные для константы равновесия, справедливы и для константы диссоциации.
 .
.
Константа диссоциации зависит от природы растворителя и температуры (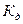 =f(Т)), но не зависит от концентрации электролита в растворе (
=f(Т)), но не зависит от концентрации электролита в растворе (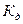 ¹f(С)).
¹f(С)).
Зависимость константы диссоциации от температуры описывается уравнением изобары Вант-Гоффа:  .
.
Пусть концентрация растворенной уксусной кислоты будет С, а степень диссоциации равна a. Тогда  ,
, 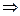
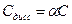 ;
; 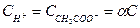 ;
; 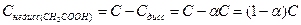 .
.
Подставим эти значения в выражение константы диссоциации:
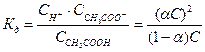 ;
; 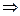
 - аналитическое выражение закона разбавления Оствальда, где С – общая концентрация электролита [моль/дм3].
- аналитическое выражение закона разбавления Оствальда, где С – общая концентрация электролита [моль/дм3].
Рассмотрим очень слабый электролит, степень диссоциации которого намного меньше единицы (a<<1). Тогда закон разбавления Оствальда преобразуется: 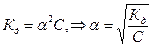 .
.
Как видно, степень диссоциации обратно пропорциональна корню квадратному из концентрации электролита. Чем больше концентрации, тем меньше степень диссоциации. В связи с этим вводится понятие бесконечно разбавленного раствора, в котором даже слабые электролиты полностью диссоциируют на ионы и отсутствуют силы электростатического взаимодействия.
ПРИЧИНЫ И МЕХАНИЗМ ИОНИЗАЦИИ
В ВОДНЫХ РАСТВОРАХ
1. Ионизация в ионных соединениях.
К ионным соединениям относятся в основном соли с ионной кристаллической решеткой. Такие соединения состоят из ионов не только в растворе, но и в кристаллическом и парообразном состоянии:
NaCl Na· + ·Cl ® Na+Cl-
Молекула воды полярна из-за разности электроотрицательности кислорода и водорода. Молекула воды имеет угловое строение. Кислород оттягивает на себя электронную плотность, так как его электроотрицательность выше, чем у водорода. На атоме кислорода возникает двойной частично отрицательный заряд, а на каждом из двух атомов водорода частично положительный заряд. Поэтому молекула воды поляризована и её можно представить в виде диполя.
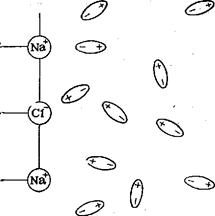 Диполи воды подходят к ионам электролита в кристаллической решетке, ориентируются в его электростатическом поле и ослабляют взаимодействие между ионами в кристалле.
Диполи воды подходят к ионам электролита в кристаллической решетке, ориентируются в его электростатическом поле и ослабляют взаимодействие между ионами в кристалле.
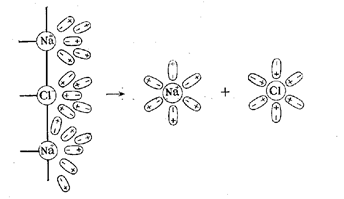 Происходит отрыв иона, его гидратация, то есть электролит растворяется в воде.
Происходит отрыв иона, его гидратация, то есть электролит растворяется в воде.
2. Диссоциация полярных соединений. Кроме гидратации (сольватации) важным фактором, приводящим к диссоциации электролита, является способность молекул растворителя образовывать разного типа связи с частицами электролита.

Например, молекулы воды обладают способностью образовывать водородные связи не только между собой, но и с другими молекулами, содержащими атомы сильно отрицательных элементов, таких как фтор, кислород, азот, хлор и другие. Например, при растворении в воде хлороводорода происходит ориентация диполей воды вокруг растворенных молекул, вызывающая ещё большую поляризацию молекул хлороводорода.
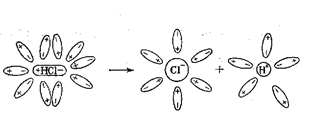
Полярная связь между атомами водорода и хлора переходит в ионную. При этом общая электронная пара целиком сдвигается к атому хлора, и в результате происходит гетеролитический разрыв молекулы. Атом хлора превращается в гидратированный хлорид-ион, а протон с молекулой воды образует сложную положительно заряженную частицу H3O+, называемую гидроксонием.
HCl + xH2O = H3O+ + Cl-(x-1)H2O
Так как гидратированная частица H3O+ и гидратированный хлорид-ион в уравнении электролитической диссоциации могут быть заменены знаками иона водорода и хлора, то уравнение можно записать так:
HCl = Н+ + Cl-.
ТЕОРИЯ СЛАБЫХ ЭЛЕКТРОЛИТОВ АРРЕНИУСА
По этой теории:
1. Электролиты – это вещества, которые в соответствующих условиях диссоциируют на ионы.
2. Процесс диссоциации характеризуется степенью диссоциации, которая возрастает с уменьшением концентрации.
3. Между ионами в растворе нет взаимодействия.
Пользуясь теорией Аррениуса, нельзя было объяснить, почему разные методы определения константы диссоциации для некоторых электролитов дают разные значения, почему для ряда электролитов константа диссоциации зависит от концентрации раствора. А также тот экспериментальный факт, что для некоторых электролитов при высоких концентрациях раствора степень диссоциации a получалась больше единицы. Теория не указывает причин, вызывающих диссоциацию молекул на ионы, и не объясняет, за счет каких сил она происходит. Поэтому существует ещё одна теория – теория сильных электролитов Кольрауша.
ТЕОРИЯ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ КОЛЬРАУША
По этой теории:
1. Сильные электролиты диссоциируют нацело даже в очень концентрированных растворах.
2. Между ионами в растворе сильных электролитов существует взаимодействие: образуются двойники, тройники и т.д., которые по своим свойствам отличаются от нейтральной молекулы.
3. Вокруг каждого иона образуется оборочка из противоположно заряженных ионов, так называемая ионная атмосфера («шуба»).
4. Ионы – это точечные заряды.
ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Растворы электролитов – это проводники 2 рода, обладающие ионной проводимостью. Количественной характеристикой способности растворов переносить электрический ток является электропроводность.
Электропроводность – это величина, обратная сопротивлению.
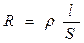 , - сопротивление,
, - сопротивление,
где R – сопротивление [Ом]; r - удельное сопротивление [Ом·м]; l – длина проводника [м]; S – площадь поперечного сечения [м2].
Различают два вида электропроводности:
1. Удельная электропроводность – то величина, обратная удельному сопротивлению.
æ= 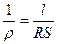 , [Ом-1·м-1] = [См/м], где См [Сименс=
, [Ом-1·м-1] = [См/м], где См [Сименс= 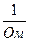 ].
].
Удельная электрическая проводимость раствора электролита – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами, имеющими площадь по 1 м2 и расположенными на расстоянии 1 м друг от друга.
Величина удельной электропроводности прямо пропорционально зависит от концентрации ионов в единице объема, скорости их движения и переносимого каждым ионом заряда.
Поиск по сайту: