 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ХІІІ.2. Розчини сильних електролітів
|
Читайте также: |
У теорії сильних електролітів важливими є питання про розподіл іонів у розчині. Уявлення про хаотичний розподіл іонів у розчині не відповідає дійсності, оскільки, вони засновані на нехтуванні електростатичної взаємодії між іонами. Електростатичні сили проявляються на відносно великих віддалях, і в сильних електролітах, де концентрація іонів значна, а віддалі між ними невеликі, електростатична взаємодія між іонами настільки значна, що вона не може не впливати на характер їх розподілення. Виникає тенденція до упорядкованого розташування, аналогічного розподілення іонів в іонних кристалах, де кожний іон оточений іонами протилежного знаку. Розподіл іонів буде визначатись співвідношенням електростатичної енергії й енергії хаотичного руху іонів. Виясняється, що ці енергії співмірні за величиною, тому реальний розподіл іонів в електроліті є проміжним між хаотичним і упорядкованим. В цьому полягає своєрідність, специфічність електролітів і труднощі, що виникають при створенні теорії електролітів, оскільки, перш за все, необхідно вияснити характер розподілу іонів.
Електростатичні сили прагнуть створити такий розподіл, при якому кожний іон оточений лише іонами протилежного знаку, але цьому протидіє хаотичний рух іонів, що веде до неупорядкованого розподілу. Ці протилежні тенденції приводять до того, що біля кожного іону утворюється іонна атмосфера, в якій переважають іони протилежного знаку в порівнянні з центральним іоном. Густина іонної атмосфери, її радіус, швидкість виникнення і руйнування складним чином впливають на термодинамічні і електропровідні властивості розчину електроліту. Вплив цих факторів піддається врахуванню лише для найпростіших електролітів і при умові значного розведення.
Термодинамічні розрахунки властивостей розчинів сильних електролітів будуються в даний час на використанні величини активності електроліту або активності його іонів. Активність визначається як величина, підставляння якої замість концентрації в термодинамічні рівняння, що дійсні для найпростіших систем, роблять їх придатними до розглядуваних розчинів. Ця величина виражає, так би мовити, активну концентрацію електроліту в розчині, відбиваючи сумарно і вплив неповної дисоціації молекул (якщо вона має місце), і вплив взаємного притягання різнойменних іонів, і вплив гідратації іонів, і інші ефекти. Активність електроліту для безмежно розбавлених розчинів наближається до значення його концентрації, а для решти – зазвичай, менша її. Для розчинів електролітів прийнято користуватись моляльною концентрацією. Зв’язок між активністю і моляльною концентрацією можна подати у вигляді такого рівняння:
 , (ХІІІ.2.1)
, (ХІІІ.2.1)
де γ – коефіцієнт активності.
У зв’язку з тим, що в розчинах електролітів одночасно присутні і катіони, і аніони розчиненої речовини (одержати розчин, що містив би лише катіони або аніони, неможливо), для таких розчинів вводяться поняття середньої іонної активності і середнього іонного коефіцієнта активності.
Якщо молекула електроліту в розчині дисоціює на ν+ катіонів і ν- аніонів, то середня іонна активність електроліту  рівна:
рівна:
 , (ХІІІ.2.2)
, (ХІІІ.2.2)
де а + і а - активність катіонів та аніонів відповідно, ν – загальне число іонів, що утворюється при дисоціації молекули електроліту (ν = ν+ + ν-).
Наприклад, для розчину CaCl2

Середній іонний коефіцієнт активності електроліту  рівний:
рівний:
 (ХІІІ.2.3)
(ХІІІ.2.3)
де γ+ і γ- - коефіцієнти активності катіонів і аніонів відповідно.
Якщо концентрація розчину виражена через моляльність b, то середня іонна активність електроліту
 , (ХІІІ.2.4)
, (ХІІІ.2.4)
де 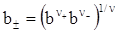 - середня іонна моляльність електроліту, ν+ і ν- - число катіонів і аніонів.
- середня іонна моляльність електроліту, ν+ і ν- - число катіонів і аніонів.
Середню іонну активність і середній іонний коефіцієнт активності електроліту визначають декількома методами: за підвищенням температури кипіння розчину; за зниженням температури замерзання розчину; за тиском пари розчинника над розчином; за ЕРС гальванічних елементів; за розчинністю малорозчинних сполук і ін.
Середня іонна активність і середній іонний коефіцієнт активності залежать не лише від концентрації розчину, але і від заряду іона. В області низьких концентрацій середній іонний коефіцієнт активності визначається зарядом іонів, що утворюються і не залежать від інших властивостей електролітів. Наприклад, в області низьких концентрацій  для розчинів KCl, NaNO3 і ін. однакові. В розбавлених розчинах
для розчинів KCl, NaNO3 і ін. однакові. В розбавлених розчинах  залежить від загальної концентрації всіх, що присутні в розчині електролітів і зарядів іонів, тобто
залежить від загальної концентрації всіх, що присутні в розчині електролітів і зарядів іонів, тобто  залежить від іонної сили розчину І, яка розраховується за формулою
залежить від іонної сили розчину І, яка розраховується за формулою
 (ХІІІ.2.5)
(ХІІІ.2.5)
де bі – моляльна концентрація і – того іона; zi – заряд іона.
При розрахунку І необхідно враховувати всі іони, що знаходяться в розчині. Наприклад, при моляльності b іонна сила розчинів NaClO4, CaBr2 i ZnCl3 рівна:

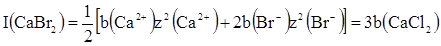
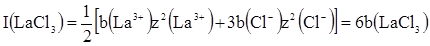
Л’юіс і Рендал сформулювали правило сталості іонної сили: в розбавлених розчинах коефіцієнт активності сильного електроліту однаковий для всіх розчинів з однією і тією ж іонною силою незалежно від природи електролітів. Це правило справедливе при концентраціях не більше 0,02 моль/л. В розчинах середніх і високих концентрацій вже є певні відхилення від цього правила, так як при більш високих значеннях іонної сили ускладнюється характер міжіонної взаємодії і проявляються індивідуальні властивості електролітів.
Наприклад. Іонна сила 0,1 М розчинів CaCl2, CoBr2, CuCl2 однакова і у відповідності з формулою (ХІІІ.1.5) рівна 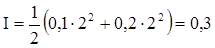 Коефіцієнти активності цих хлоридів в 0,1 М розчині рівні 0,518 (CaCl2); 0,540 (CoBr2); 0,510 (CuCl2). В 1 М розчині цих електролітів іонна сила складає:
Коефіцієнти активності цих хлоридів в 0,1 М розчині рівні 0,518 (CaCl2); 0,540 (CoBr2); 0,510 (CuCl2). В 1 М розчині цих електролітів іонна сила складає:  і коефіцієнти активності відрізняються вже більш суттєво: 0,500 (CaCl2); 0,682(CoBr2); 0,419(CuCl2).
і коефіцієнти активності відрізняються вже більш суттєво: 0,500 (CaCl2); 0,682(CoBr2); 0,419(CuCl2).
Сучасна кількісна теорія розчинів сильних електролітів, що одержала назву електростатичної, була запропонована в 1923р. П.Дебаєм і Е.Гюккелем. В основу цієї теорії покладені такі положення:
1. Іони електроліту взаємодіють один з одним. Сили взаємодії електростатичні і можуть бути розраховані за законами електростатики.
2. Розчинник впливає на взаємодію іонів. Цей вплив враховується введенням діелектричної сталої розчинника як неперервного однорідного середовища.
3. Взаємодія іона (в теорії він називається центральним) з іонами, що його оточують в середньому рівноцінне його взаємодії з уявною іонною атмосферою, що володіє неперервним розподілом електричного заряду.
4. Розмірами центрального іону можна знехтувати і вважати його точковим зарядом.
В цій теорії залишається неврахованим ряд суттєвих взаємодій і властивостей іонів. Теорія не враховує, наприклад, сольватацію іонів, їх здатність до поляризації тощо, що суттєво обмежує застосування теорії.
Вивід основного рівняння цієї теорії заснований на застосуванні закону розподілу Больцмана для обчислення густини заряду в іонній атмосфері.
Локальна концентрація іонів електроліту 1-1 сі. а в даній точці іонної атмосфери може бути розрахована за рівнянням
 (ХІІІ.2.6)
(ХІІІ.2.6)
де с – середня концентрація іонів у всьому об’ємі розчину; Е – потенціальна енергія іона в даній точці іонної атмосфери, що рівна добутку zey (тут z – валентність іона, е – заряд електрона, ψ – електростатичний потенціал у даній точці іонної атмосфери); kБ – константа Больцмана, Т – температура.
В розбавлених водних розчинах електролітів енергія теплового руху значно перевищує потенціальну енергію іонів, тобто kБТ > zey. А тому експоненціальний множник в рівнянні (ХІІІ.1.6) можна розкласти в ряд, обмежившись першими двома членами:
 (ХІІІ.2.7)
(ХІІІ.2.7)
Для іонів іонної атмосфери одного заряду з центральним іоном, тобто коли z і ψ одного знаку, множник  <1 і сі. а <c. Для випадку, коли z і ψ різного знаку, множник
<1 і сі. а <c. Для випадку, коли z і ψ різного знаку, множник  >1 і сі. а >c.
>1 і сі. а >c.
Знаючи локальну концентрацію іонів у даній точці поля, неважко знайти густину заряду ρ у цій точці. Очевидно, вона рівна різниці локальних концентрацій катіонів і аніонів:
 , (ХІІІ.2.8)
, (ХІІІ.2.8)
де І – іонна сила. Множник 1000 в знаменнику введено тому, що, зазвичай, концентрацію виражають числом моль у літрі, а густину заряду відносять до 1см3.
Енергія, що пов’язана з іонною атмосферою, має електричне походження, тому вона повинна бути функцією густини електричного заряду і потенціалу, що створюється іонною атмосферою. Оскільки остання є статистичним утворенням, можна не враховувати дискретного розподілу зарядів і використовувати рівняння Пуассона для зв’язку між середньою густиною заряду ρ і таким, що відповідає йому середнім значенням потенціалу ψ:
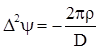 , (ХІІІ.2.9)
, (ХІІІ.2.9)
де ∆ - оператор Лампаса, D – діелектрична проникливість.
З урахуванням рівняння (ХІІІ.2.8) і рівняння Пуассона (ХІІІ.2.9) можна записати так:
 (ХІІІ.2.10)
(ХІІІ.2.10)
Вираз  х2 і тоді х =
х2 і тоді х =  (ХІІІ.2.11)
(ХІІІ.2.11)
(х має розмірність довжини -1, тому величину 1/х часто називають довжиною або товщиною іонної атмосфери). Товщина іонної атмосфери залежить від температури, діелектричної проникливості розчинника, числа і заряду іонів і міняється від десятих частинок нанометра до декількох нанометрів.
Якщо прийняти, що відмінність між потенціалом реального розчину електроліту μ і хімічним потенціалом ідеального розчину такої ж концентрації μід обумовлено лише електростатичними силами, то
 , (ХІІІ.2.12)
, (ХІІІ.2.12)
де ∆Gел – внесок електростатичної взаємодії в енергію Гіббса.
Така різниця між хімічними потенціалами може бути визначена і за таким рівнянням:
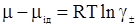 , (ХІІІ.2.13)
, (ХІІІ.2.13)
де γ± – коефіцієнт активності електроліту.
При поєднанні рівнянь (ХІІІ.2.12) і (ХІІІ.2.13) одержуємо:
 (ХІІІ.2.14)
(ХІІІ.2.14)
Енергія Гіббса електростатичної взаємодії іонів розраховується за законами електростатики:
 (ХІІІ.2.15)
(ХІІІ.2.15)
Поєднуючи рівняння (ХІІІ.2.14) і (ХІІІ.2.15) одержуємо
 (ХІІІ.2.16)
(ХІІІ.2.16)
Якщо вважати, що іони, які утворюють іонну атмосферу, розташовані на поверхні сфери радіусом х,в центрі якої знаходиться центральний іон, що розглядається, то за законами електростатики іонна атмосфера створює в центрі потенціал ψ, що рівний
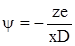 (ХІІІ.2.17)
(ХІІІ.2.17)
Підставляючи в рівняння (ХІІІ.2.16) значення ψ одержуємо
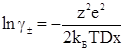 (ХІІІ.2.18)
(ХІІІ.2.18)
Поєднуючи рівняння (ХІІІ.2.18) і рівняння  (ХІІІ.2.11) одержуємо:
(ХІІІ.2.11) одержуємо:
 (ХІІІ.2.19)
(ХІІІ.2.19)
Для водних розчинів при 298 К А = 0,51z2 і тоді
 (ХІІІ.2.20)
(ХІІІ.2.20)
Виведені закономірності справедливі лише для розбавлених розчинів сильних електролітів.
Для більш значних концентрацій в рівняння слід вносити поправку – замінити х величиною  , де а – діаметр іона і тоді
, де а – діаметр іона і тоді
 (ХІІІ.2.21)
(ХІІІ.2.21)
Ця поправка розширює межі застосування теорії Дебая-Гюккеля для водних розчинів 1,1 – бінарних електролітів до концентрацій 0,1 – 0,5 моль/л. Для концентрованих розчинів ці поправки недостатні. Для розрахунків коефіцієнтів активності в таких розчинах слід враховувати цілий ряд взаємодій: взаємодію іонів з молекулами розчинника, ки-дер-ваальсові сили, можливі з’єднання іонів в пари, трійки, утворення комплексів з розчинником та ін. Е. Гюккель запропонував ввести в рівняння додаткову складову:
 (ХІІІ.2.22)
(ХІІІ.2.22)
Ця формула добре погоджується з дослідними даними. В ній В – емпіричний коефіцієнт, що залежить від природи електроліту і розчинника. Величина коефіцієнту В зазвичай не перевищує 0,1 і знаходиться він експериментально. При розбавлянні розчину член ВІ швидко зменшується і величина lnγі наближається до значення 
Недоліки теорії Дебая-Гюккеля пов’язані з недосконалістю і обмеженістю її теоретичних припущень, в якій розглядаються лише електростатичні взаємодії іонів і опосередкований вплив оточуючого середовища. В сучасних теоріях концентрованих розчинів електролітів, окрім утворення різних асоціатів, враховується сольватація іонів і їх кінцеві розміри, асиметричність розподілення концентрації в іонній атмосфері, що рухається, локальні зміни в’язкості біля іонів, взаємодія електрофоретичного і релаксаційного гальмування і інші ефекти. Очевидно, що більш точні дослідження розчинів електролітів можливі лише з урахуванням всієї складності їх будови і різноманітних взаємодій.
Поиск по сайту: