 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Гетерогенного каталізу
|
Читайте также: |
Гетерогенний каталіз займає провідне місце в сучасній хімічній промисловості. Він дозволяє інтенсифікувати виробничі процеси, використати більш доступні і дешеві вихідні матеріали, одержати нові речовини з необхідними властивостями. В даний час гетерогенно-каталітичні процеси використовують у таких важливих виробництвах, як одержання сірчаної кислоти, синтез аміаку, метанолу, одержання синтетичного палива, штучного каучуку, пластичних мас та ін.
У ролі гетерогенних каталізаторів, зазвичай, використовують тверді тіла. Каталітична реакція в цьому випадку протікає на поверхні розділу фаз тверда – газоподібна або тверда – рідина, а її швидкість пропорційна величині цієї поверхні. У зв’язку з цим важливою характеристикою гетерогенних каталізаторів є поверхня одиниці маси каталізатора – питома поверхня
 , (XII.3.1)
, (XII.3.1)
де S – загальна площа поверхні розділу фаз, м2; mк – маса каталізатора, г; Sпит – питома поверхня каталізатора, м2/г. Висока питома поверхня забезпечується розвинутою пористою структурою твердих каталізаторів. Стінки пор утворюють внутрішню поверхню, яка для промислових каталізаторів складає 5 – 500 м2/г. Зовнішня поверхня зерен каталізатора, зазвичай, не перевищує 0,01 – 1 м2/г. Ефективність гетерогенних каталізаторів, як уже відмічалось вище, визначається також структурою, хімічним складом їх поверхневого шару.
В гетерогенно-каталітичних реакціях, як і в інших гетерогенних процесах, можна виділити ряд стадій. Ними є дифузія, що забезпечує підведення вихідних речовин до поверхні каталізатора, адсорбція їх на цій поверхні, взаємодія адсорбованих речовин з утворенням продуктів реакції, десорбція продуктів і відведення продуктів реакції від поверхні каталізатора в глибину відповідної фази за допомогою дифузії. В залежності від визначаючої стадії реакція може протікати в дифузійній, кінетичній або перехідній області. Зі зміною зовнішніх умов роль визначаючої стадії може перейти до іншого процесу.
 Особливе значення в гетерогенних каталітичних процесах має активована адсорбція. На відміну від неспецифічної і фізичної адсорбції, що володіє малою енергією активації, активована адсорбція забезпечується силами хімічної природи. Досліди показали, що висока каталітична активність часто супроводжується значною активованою адсорбцією.
Особливе значення в гетерогенних каталітичних процесах має активована адсорбція. На відміну від неспецифічної і фізичної адсорбції, що володіє малою енергією активації, активована адсорбція забезпечується силами хімічної природи. Досліди показали, що висока каталітична активність часто супроводжується значною активованою адсорбцією.
Хід реакції на поверхні каталізатора з урахуванням стадій адсорбції і десорбції схематично показаний на рис.71.
Енергія вихідних реагентів Е1 після їх адсорбції стає рівною Е2. Потім відбувається хімічне перетворення, долається енергетичний бар’єр і утворюються продукти з енергією Е3, що теж знаходяться в адсорбованому стані. Після десорбції продуктів енергія змінюється і приймає значення Е4. На рисунку видно, що енергія активації найбільш ускладненої стадії Еіст менша енергії активації Е реакції, що протікає без каталізатора, і при інших рівних умовах повинна спричиняти підвищенню швидкості реакції. Величина Еіст відповідає хімічній реакції, що протікає на поверхні каталізатора, і може бути названа істинною енергією активації.
Швидкість адсорбції, якщо розглядати газову реакцію, буде пропорційна концентрації газу і числу вільних центрів на поверхні адсорбенту (X.2.9), а швидкість десорбції – ступеню заповнення поверхні a (Х.2.10).
Оскільки  , тобто швидкість пропорційна ступеню заповнення, то порядок (істинний порядок) хімічного перетворення рівний одиниці. Використовуючи співвідношення (X.2.13), в якому К замінимо на b одержуємо рівняння:
, тобто швидкість пропорційна ступеню заповнення, то порядок (істинний порядок) хімічного перетворення рівний одиниці. Використовуючи співвідношення (X.2.13), в якому К замінимо на b одержуємо рівняння:
 , (XII.3.2)
, (XII.3.2)
що містить залежність швидкості від об’ємної концентрації вихідної речовини. При малих концентраціях газу (b·с<<1) і
 (XII.3.3)
(XII.3.3)
У цих умовах реакція має уявний порядок, рівний одиниці. При b·с>>1
 , (XII.3.4)
, (XII.3.4)
це означає, що уявний порядок рівний нулю. Очевидно, при середніх концентраціях газу уявний порядок повинен бути дробовим і знаходитись між нулем і одиницею.
Розглянемо стаціонарну газову реакцію типу А + В → Р, яка протікає на твердому каталізаторі, передбачаючи, що вона включає стадію адсорбції газів А і В. Використаємо формули ступеня заповнення поверхні речовинами А і В
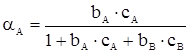 і
і 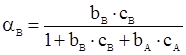 (XII.3.5)
(XII.3.5)
справедливі для ленгмюрівської адсорбції.
Швидкість цієї реакції можна вважати пропорційною величинам aА і aВ, а істинний порядок, відповідно, рівний двом. Таким чином, можна записати рівняння:
 , (XII.3.6)
, (XII.3.6)
і скориставшись рівняннями (XII.3.5), матимемо
 (XII.3.7)
(XII.3.7)
Очевидно, при малих концентраціях знаменник рівняння (XII.3.7) близький до одиниці, а швидкість пропорційна добутку сА·сВ. В цьому випадку уявний порядок рівний двом.
У випадку, коли один газ добре адсорбується, а другий погано, в знаменнику цього рівняння залишається лише та частина, яка відноситься до газу, що добре адсорбується, наприклад (bА·сА)2. Після скорочень рівняння для швидкості буде таким:
 (XII.3.8)
(XII.3.8)
З цього рівняння виходить, що швидкість обернено пропорційна концентрації добре адсорбованого газу. Уявний порядок реакції за речовиною А рівний мінус одиниці. Наприклад, швидкість взаємодії оксиду вуглецю (II) з киснем, що відбувається на поверхні платинового каталізатора, зменшується зі зростанням концентрації оксиду вуглецю (II). Це пояснюється витісненням молекулами СО молекул О2,що викликається зниженням концентрації адсорбованого кисню.
Рівняння Ленгмюра і зроблені в цій теорії припущення не завжди погоджуються з досвідом. Існують більш точні рівняння ізотерм адсорбції, що враховують можливу неоднорідність адсорбційних центрів, взаємодію адсорбованих молекул, пористу структуру поверхні адсорбенту та інші фактори.
Поиск по сайту: