 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Соединения золота
Соединения со степенью окисления +1. У золота данная степень окисления проявляется редко. Оксид Au2O (синий золь или фиолетовый порошок) получают кипячением хлорида золота со щелочами:
2АuCl + 2КОН = Au2O + 2KCl + H2O
Хлорид золота(I) желтого цвета получают при 1750 °С:
Аu+3Cl3 = Au+1Cl + Cl2
Соединения золота в степени окисления +1 - сильные восстановители и легко окисляются, переходя в устойчивые производные золота(III). Для соединений золота(I) также характерны реакции диспропорционирования:
3Аu+1Cl + КСl = K[Аu+3Cl4] + 2Аu;
3Au2+1O = Au2+3O3 + 4Аu0
Более устойчивы координационные соединения золота(I), так в кристаллическом виде выделены K[Аu(CN)2], H[Аu(CN)2].
Соединения со степенью окисления +3. Степень окисления +3 наиболее характерна для золота. Золото(III) образует бинарные соединения: оксид, галогениды, сульфид:
| Соединение | Au2O3 | AuF3 | AuСl3 | AuBr3 | Au2S3 |
| Цвет | черно-бурый | оранжевый | красный | темно-бурый | черный |
| Растворимость | нет | нет | растворим | растворим | нет |
Хлорид золота(III) является основным исходным реагентом для получения других соединений золота. Хлорид и бромид состоят из димерных плоских молекул с длиной связи d(Au-Cl) = 0,22 – 0,23 нм:
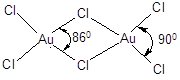
Оксид, гидроксид, галогениды золота(III) амфотерные соединения с преобладанием кислотных свойств. Например, гидроксид легко растворяется в щелочах, образуя тетрагидроксоаураты(III):
Аu(ОН)3¯ + КОН = K[Аu(ОН)4]
Растворение в кислотах также приводит к образованию координационных соединений золота анионного типа с координационным числом равным 4:
Аu(ОН)3 + 4НNO3 = H[Аu(NO3)4] + 3H2O
Тетранитрато- и тетрацианоаураты(III) водорода (H[Аu(CN)4]) выделены в свободном состоянии. В присутствии соответствующих солей щелочных металлов соединения золота(III) образуют комплексы состава М+1[Аu(NO3)4], М+1[Аu(СN)4], М+1[АuS2] и пр. Например:
AuCl3 + NaCl = Na[AuCl4]
Особая склонность золота(III) к образованию анионных комплексов проявляется и при гидролизе его галогенидов. Например:
АuСl3 + Н2O  H[Au(OH)Cl3]; АuСl3 + Н2O
H[Au(OH)Cl3]; АuСl3 + Н2O  H2[AuOCl3]
H2[AuOCl3]
Поиск по сайту: