 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Вопрос 25
.Основное уравнение молекулярно-кинетической теории идеальных газов выводится в предположении, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами пренебрежимо мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие.
p=(1/3)nm<vкв>2, (2)
где n = N/V - концентрация молекул газа, N - число молекул газа, V - объем газа, <vкв> = [(1/N)  vi2]1/2 - среднеквадратичная скорость молекул, vi - скорость i-молекулы, m - масса одной молекулы.
vi2]1/2 - среднеквадратичная скорость молекул, vi - скорость i-молекулы, m - масса одной молекулы.
Суммарная кинетическая энергия поступательного движения всех молекул газа E = N[m<vкв>2/2] и, следовательно, уравнение (2) можно записать pV = (2/3)E.
Если сравнить уравнение (2) с уравнением Клапейрона-Менделеева (1), то можно получить выражения для среднеквадратичной скорости молекул <vкв> = 
(3a)
и для средней кинетической энергии поступательного движения одной молекулы идеального газа
<Ek> = 3kT/2. (4)
Таким образом, термодинамическая температура Т является мерой средней кинетической энергии поступательного движения молекул идеального газа и формула (4) раскрывает молекулярно-кинетическое толкование температуры.
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА – разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул.
23.
1. Статистический метод – лежит в основе молекулярной физики. Использует теорию вероятности и определенные модели строения изучаемых систем.
2. Термодинамический метод –лежит в основе термодинамики. Основа т/д метода –определение состояния т/д системы.
Т/д параметры: P, V, T, ρ, m, M.
Ур-ие состояния: f(P, V,T)=0.
Состояние ТД наз-ся равновесным, если значение всех ТД параметров не меняется во времени.
Температура – скалярная величина, характеризующая давление внутри равновесной системы.
· Изотермический процесс, при котором температура системы не изменяется (T=const)
· Изохорный процесс, происходящий при постоянном объёме системы (V=const)
· Изобарный процесс, происходящий при постоянном давлении в системе (P=const)
· Адиабатический процесс, проходящий без теплообмена, поэтому при неизменной энтропии в системе (S=const)
24.
1) З-н Бойля - Мариотта.
Изотермический процесс: m=const, T=const, pV=p´V´
2) З-н Гей – Люсака.
Изобарный процесс: m=const, p=const, V1/T1=V2/V2
3) З-н Шарля.
Изохорный процесс: m=const, V=const, p1/T1=p2/T2
З-н Авогадро: в равных объёмах любых газов, при одинаковых условиях, содержится одинаковое число молекул.
З-н Дальтона: Pсм=P1+P2+P3+…+Pпоряд.
Уравнение состояния газа (ур-ие Клайперона): m= const, pV/T=const
Ур-ие Менделеева-Клайперона: pV=(m/M)RT, pV=νRT
25. Модель идеального газа:
1. V молекулы мал по сравнению с V сосуда.
2. Отсутствуют силы взаимодействия.
3. Столкновения молекул абсолютно упругие.
Давление – совокупность ударов.
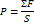

n=N/V
ΔP1=2m0V=(m0υ-(-m0υ))
26. Закономерности, которым подчиняются явления, в которых участвует большое количество однородных объёктов, наз-ся статистическими.


Газ – статистически большой ансамбль частиц.
В газе устанавливается некоторое стационарное, не меняющееся распределение молекул, которое подчиняется вполне определенным статистическим законам.
З-н Максвелла описывает f(υ), называемой функцией распределения по скоростям dυ от υ до (υ+dυ).
dN(υ)
Ф-ла Максвелла определяет:
1) f(υ) определяет относительное число молекул, скорости которых лежат в интервале dυ(υ; υ+dυ).
f(υ) = 
2)  – вероятность того, что скорость частицы лежит в интервале dω (ω;ω+dω)
– вероятность того, что скорость частицы лежит в интервале dω (ω;ω+dω)

f (υ) зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т).
Скорости, характеризующие состояние газа:



27. При выводе МКТ мы не учитывали влияние силы, действующей на тело.
В реальности молекулы любого газа находятся в поле тяготения Земли. Тяготение с одной стороны, тепловое движение с другой приводят к некоторому стационарному состоянию газа, при котором давление с высотой убывает.
Параметрическая формула высоты над уровнем моря: если h1=0, 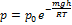
Преобразуем параметр. формулу: P=nkT


Билет №28: Основы термодинамики.
Внутренняя энергия - физ. величина, равная сумме кинетических энергий беспорядоченного движения частиц тела и потенциальных энергий межмолекулярного взаимодействия между частицами(не входит энергия движения тела и потенциальная энергия тела, находящегося в силовом поле).
Число степеней свободы i -число независимых параметров, определяющих положение тела в пр-ве. Положение м.т. в пр-ве опред-ся координатами x,y,z => м.т. имеет 3 степени свободы(поступательные). Положение тв. тела в пр-ве опред-ся координатами x,y,z и углами a,b,c, т.е. ТВ. Тело имеет 6 степеней свободы(3-поступательных и 3-вращательных). Две жестко связанные м.т. имеют 5 степеней свободы(3-поступательные, 2-вращательные).
Закон распределения энергии по степеням свободы: «на каждую степень свободы(поступательную, вращательную, колебательную) в среднем приходится одинаковая кинетическая энергия равная: E=1/2kT; i=iвращ+iпост+2iколеб.
Для идеального газа внутр. энергия представляет собой кинетическую энергию хаотического теплового движ-я его молкул: U=m/M*i/2*RT.
Внутр. энергия яв-ся однозначной ф-цией состояния системы, т.е. зависит только от параметров P,V,T и не зависит от способа, каким то состояние достигнуто.
Поиск по сайту: