 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Лекция 2. Теория ликвационных методов рафинирования металлов
Ликвацией называется нарушение однородности раствора в жидком состоянии или в процессе плавления (затвердевания). В системе, которая становится гетерогенной, фазы разобщаются, вследствие различия плотностей, стремясь образовать самостоятельные слои.
Имеется три способа проведения ликвации:
1) Выплавлением более легкоплавкого металла (зейгерование);
2) Кристаллизация при понижении температуры (ликвация);
3) Кристаллизация при постоянной температуре, но с добавлением присадок, приводящих к нарушению однородности расплава и к ликвации.
Все эти процессы основаны на явлении плавления и кристаллизации.
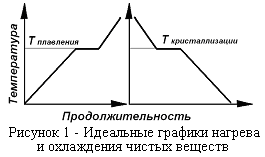
Плавление и кристаллизация в однокомпонентной системе. Теплосодержание вещества может быть рассчитано по уравнению (рисунок 1):
ΔН = СРтв(Тпп – То) + СР′тв(Тпл – Тпп) + λпл + + СРж(Ткон – Тпл)
При полиморфном превращении увеличивается количество тепла, поглощенное телом. То же самое и при плавлении. С изменением температуры изменяется и теплоемкость тела. Величина теплоемкости может быть определена по формуле Ср = С0 + аТ2 + вТ3.
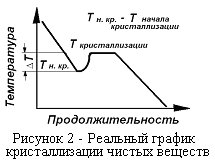
Рассмотрим кривые нагревания и охлаждения для металлов (рисунок 1, 2). Для большинства элементов и чистых химических соединений переход из твердого состояния в жидкое совершается при постоянной температуре. При охлаждении с небольшой скоростью отвода тепла при достижении температуры кристаллизации (плавления) начинается процесс кристаллизации, который идёт при постоянной температуре.
| 
|
В реальных системах, кристаллизация наступает после переохлаждения на 2÷20°. Явление переохлаждения вызывается отсутствием в расплавленном металле центров кристаллизации. Для возникновения первичных центров кристаллизации необходим интенсивный отвод тепла. С появлением центров кристаллизации температура металла устанавливается на значении, соответствующем температуре плавления металла (рисунок 2). Величина ΔТ зависит от физико-химических свойств кристаллизующегося вещества и от скорости отвода тепла из системы.
Теплоемкость сплавов и химических соединений. Теплоемкость сплавов в первом приближении можно считать свойством аддитивным и вычислять по следующей формуле Реньо:  , где: С – удельная теплоемкость сплава; с1... ci – удельная теплоемкость компонентов сплава; n1 ... ni – процентное содержание компонентов сплава.
, где: С – удельная теплоемкость сплава; с1... ci – удельная теплоемкость компонентов сплава; n1 ... ni – процентное содержание компонентов сплава.
Теплоемкость химического соединений приближенно может быть вычислена на основании закона Копа–Неймана, согласно которому теплоемкость соединения равна сумме атомных теплоемкостей элементов, входящих в состав данного соединения: С = n1C1 + n2C2 +... niCi, где: C – молекулярная теплоемкость соединения; C1, C2 – атомные теплоемкости элементов, входящих в состав данного соединения; n1, n2 – число атомов данного элемента в данном соединении.
Термодинамика процесса кристаллизации. Процесс кристаллизации твердой фазы металла из жидкого сплава подчиняется при T = const уравнению изохоры Вант – Гоффа: 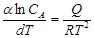 .
.
СА – молекулярная концентрация вещества А в жидком насыщенном растворе при данной Т; Q – теплота растворения 1 моля кристаллов А в бесконечно большом количестве насыщенного при данной температуре раствора вещества А в расплаве, причем Q – положительно, если при растворении тепло выделяется, т.е.: Акр + ж ↔ (Асплав)ж + Q; и отрицательно если оно поглощается. При этом константа равновесия Кс = СА.
Если принять, что теплота равновесия а в насыщенном сплаве не зависит от температуры и концентрации насыщенного раствора, то интегрирование уравнения в пределах от Т до Тпл,, где Тпл – температура плавления чистого вещества А, дает:  .
.
Теплота растворения Q слагается из двух величин: Q = -λпл + q,,где: λпл – скрытая теплота плавления 1 моля чистого вещества А; q – теплота смешения (растворения) 1 моля расплавленного вещества А в насыщенном растворе вещества А..
Если величина q очень мала по сравнению с λ, то ею можно пренебречь. Тогда: Q = - λпл и lnCA = 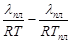 - одно из основных уравнений кристаллизации. Подставляя эту функцию Q = f(T), в уравнение Вант-Гоффа и интегрируя, получим:
- одно из основных уравнений кристаллизации. Подставляя эту функцию Q = f(T), в уравнение Вант-Гоффа и интегрируя, получим:  и
и 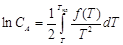 . Эти уравнения связывают температуру начала кристаллизации и концентрацию вещества А в сплаве, т.е. определяют направление линии ликвидуса на диаграммах плавкости.
. Эти уравнения связывают температуру начала кристаллизации и концентрацию вещества А в сплаве, т.е. определяют направление линии ликвидуса на диаграммах плавкости.
Если из расплава кристаллизуются не чистые кристаллы вещества А, а твердый раствор А переменного состава, т.е. с различным содержанием вещества А, то: 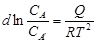 , где: СА - молекулярная концентрация вещества в жидком расплаве;
, где: СА - молекулярная концентрация вещества в жидком расплаве; 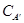 - молекулярная концентрация вещества А в кристаллизирующейся фазе твердого раствора; Q – теплота растворения 1 моля вещества А из кристаллической фазы твердого раствора А' в жидком насыщенном веществом А растворе при данной температуре.
- молекулярная концентрация вещества А в кристаллизирующейся фазе твердого раствора; Q – теплота растворения 1 моля вещества А из кристаллической фазы твердого раствора А' в жидком насыщенном веществом А растворе при данной температуре.
В этом случае Q = - λпл + (q' – q), где: λпл – скрытая теплота плавления чистого вещества А при Т; q' – q – разность теплот растворения 1 моля расплавленного вещества А в большом количестве насыщенного раствора (q') и теплоты растворения 1 моля твердого вещества А в большом количестве твердого насыщенного раствора А'.
В большинстве случаев для расплавленных сред теплоты q' и q очень малы по сравнению с λпл, тем более мала их разность, поэтому этой величиной можно пренебречь и считать: Q = - λпл.
Интегрирование и подстановка дают: 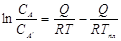 или
или 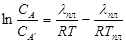
Диаграммы состояния бинарных систем. Рассмотрим несколько типичных диаграмм плавкости двухкомпонентных систем.
Выделяют несколько видов бинарных диаграмм состояния. Рассмотрим основные из них.
I. Диаграммы состояния двухкомпонентных систем с неограниченной растворимостью компонентов в твердом состоянии друг в друге (образующих непрерывный ряд твердых растворов).
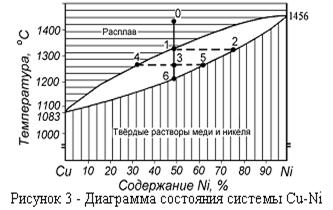
Твердыми растворами называют фазы, в которых основной компонент сохраняет свою кристаллическую решетку, а атомы другого - располагаются, в ней, слегка изменяя ее размеры, но не форму и тип. Непрерывные твердые растворы образуются при любом соотношении компонентов. На рисунке 3 изображена диаграмма состояния сплавов меди с никелем, из которой видно, что медь и никель плавятся при постоянных температурах, а все их сплавы в интервале температур.
Согласно правилу фаз, в верхней и нижней частях диаграммы в однофазных системах число степеней свободы равно 2 + 1 - 1 = 2 и, следовательно, в этих областях можно произвольно менять температуру и состав сплава без изменения числа фаз и её характера.
По диаграммам состояния возможны количественные расчеты соотношения масс присутствующих фаз. На рассматриваемой диаграмме соотношение количеств жидкой и твердой фаз в точке 3 определяется отношением отрезков 3— 4 и 3—5.
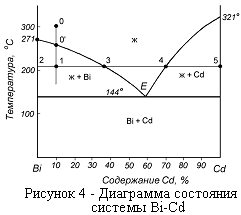
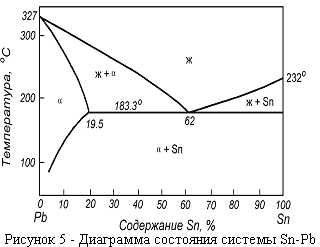
2. Диаграммы состояния эвтектического типа.
Диаграммы состояния эвтектического типа наиболее распространены в металлургической практике. В простейшем варианте они бывают двух видов - без ограниченных по составу твердых растворов (рисунок 4 ) и с областями их образования (рисунок 5 ). Сплавы, лежащие слева от Е, называются доэвтектическими, справа - заэвтектическими. Все сплавы, кроме эвтектического, затвердевают в интервале температур. Начинается их кристаллизация при температурах, определяемых точкой пересечения прямой, определяющей состав сплава (прямая 0 – 1 на рисунке 4) с линией ликвидус.
| 
|
По диаграмме (рисунок 4)можно определить не только число образующихся фаз, но и их количественное соотношение. Так, количество кристаллов висмута и оставшегося расплава на отрезке 2—3 определяется из соотношения длин отрезков 1—2 и 1—3.
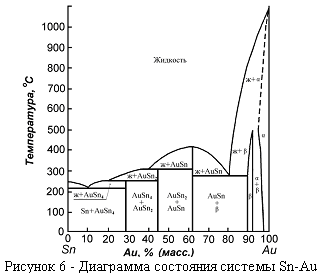
3. Диаграммы состояния с химическим соединением.
Химические соединения, образующиеся между компонентами сплава, называются металлидами или интерметаллидами, и характеризуются металлическим типом связи. В системе олово - золото (рисунок 6) существуют три интерметаллических соединения.
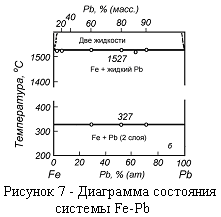
4. Диаграммы состояния с нерастворимыми твердыми и жидкими компонентами.
На рисунке 7 -диаграмма состояния системы железо - свинец. В любых концентрациях свинец застывает при 327 °С, а железо при 1527 °С, не смешиваясь. Выше 1527 °С штриховой линией показана область их расслаивания в расплавленном состоянии, выше которой расплавы смешиваются.
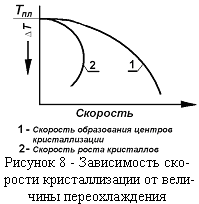
Механизм и кинетика процесса кристаллизации. При застывании расплавленного металла можно выделить два одновременно протекающих процесса. Это: образование центров кристаллизации (процесс, требующий некоторого переохлаждения), и рост кристаллов.
Скорость процесса кристаллизации зависит от скорости протекания обоих процессов, в то же время скорость процесса роста кристаллов зависит от скорости образования центров кристаллизации. С увеличением интервала переохлаждения наблюдается увеличение скорости образования центров кри-сталлов (рисунок 8). До некоторого предела увеличивается и скорость роста кристаллов. Однако, при некотором переохлаждении наступает уменьшение скорости кристаллов. В случае сильного переохлаждения будут получаться мелкие кристаллы. Возможно даже отсутствие кристаллизации. В этом случае будут получены аморфные металлы. При небольшом переохлаждении получаются крупные кристаллы. Так получают монокристаллы.
Скорость разделения фаз при ликвации. Закон Стокса. Скорость разделения фаз может быть определена по уравнению Стокса: 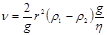 , где: r - радиус частицы, см;
, где: r - радиус частицы, см; 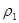 - плотность частицы, г/см3;
- плотность частицы, г/см3; 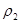 - плотность среды, г/см3;
- плотность среды, г/см3; 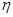 - вязкость среды, Па·с; g - ускорение силы тяжести, см/сек.
- вязкость среды, Па·с; g - ускорение силы тяжести, см/сек.
Разделение металла (штейна) и шлака ликвацией. В металлургической практике важнейшим процессом разделения двух жидких фаз является отделение шлака от металла и шлака от штейна при плавках. Расплавленные металлы и их сульфиды мало растворимы в шлаках (рисунок 9), поэтому можно при плавке руд отделить сравнительно небольшое количество металла или штейна от основной массы пустой породы.
Поиск по сайту: