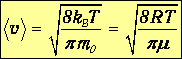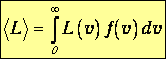|
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Пример. Найдем, какая часть общего числа молекул кислорода имеет при температуре 27ґС скорости, отличающиеся от наиболее вероятной не более
|
Читайте также: |
Найдем, какая часть общего числа молекул кислорода имеет при температуре 27ґС скорости, отличающиеся от наиболее вероятной не более, чем на 1%; а также скорости в интервале 562 - 572 м/с.
Произведем необходимые вычисления. Чтобы ответить на первый вопрос задачи, учтем, что и=1 при v=vВЕР. Величина интервала du=0.02. Следовательно,
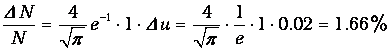
Вычислим наиболее вероятную скорость:
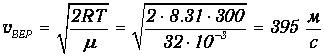
Найдем отношение v=562 м/с к vВЕР=395 м/с
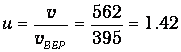
Определим по кривой (см. рис. 3.4) значение функции f(u) при и=1.42. Получаем f(u) = 0.62. Ширина интервала Dv = 10 м/с (Du = 10/395 = 0.0253). Следовательно, доля молекул в этом интервале

Интересно отметить, что молекула кислорода проходит за секунду путь, равный в среднем 0.4 км. Но не нужно забывать о соударениях молекул. Из-за них молекула по прямой движется очень недолго, и ее путь представляет собой ломаную линию. Поэтому молекула, двигаясь с огромной скоростью по отдельным звеньям ломаной траектории, передвигается от слоя к слою газа со сравнительно небольшой скоростью.
Средняя арифметическая скорость. Знание функции распределения молекул по скоростям f(v) дает возможность найти среднее значение скорости, а также любой величины, являющейся функцией скорости, например квадрата скорости v2 или кинетической энергии молекулы mv2/2.
| Средняя арифметическая скорость <v> - это отношение суммы абсолютных величин скоростей всех молекул в системе к числу этих молекул. |
Разобьем интервал всех возможных значений скорости от 0 до бесконечности на малые интервалы Dvi. Каждому интервалу соответствует количество молекул
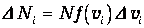
| (3.35) |
Так как интервалы Dvi, малы, то можно приближенно считать скорости молекул данного интервала одинаковыми и равными vi. Сумма значений скоростей молекул интервала
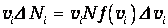
| (3.36) |
Сумма значений скоростей всех молекул
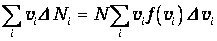
| (3.37) |
Разделив эту сумму на число молекул, получим выражение для средней арифметической скорости
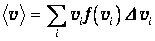
| (3.38) |
Переходя от суммы к интегралу, получаем
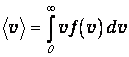
| (3.39) |
После вычислений определяем среднюю арифметическую скорость молекул
| (3.40) |
Среднеквадратичная скорость. Чтобы найти среднее значение произвольной функции L(v) скорости, нужно эту функцию умножить на функцию распределения и проинтегрировать по всем возможным значениям скорости:
| (3.41) |
В частности, при L(v)=v отсюда находится <v>.
Среднее значение квадрата скорости равно отношению суммы квадратов скоростей всех молекул системы к общему числу молекул. Таким образом,
| (3.41) | ||||
Среднеквадратичная скорость -это корень квадратный из среднего квадрата скорости молекул
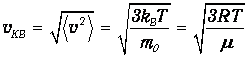
| |||||
Следует отметить, что характерные скорости отличаются друг от друга лишь численными множителями, причем
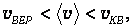
| (3.43) |
а зависимость от Т и т0 (или m) у них одинаковая.
Через среднеквадратичную скорость выражается средняя кинетическая энергия поступательного движения молекул
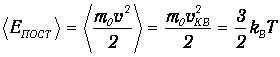
| (3.44) |
Этот результат находится в согласии с формулой (1.14) кинетической теории идеальных газов и с законом о равнораспределении энергии, который гласит, что на каждую степень свободы молекулы приходится энергия kBТ/2. Три степени свободы поступательного движения молекулы как раз соответствуют полученному здесь результату (3.44). В сущности, именно для того, чтобы получить такое соответствие, мы выбрали должным образом коэффициент a в (3.26).
Эксперимент по проверке распределения Максвелла. Необходимо еще раз подчеркнуть, что установленный Максвеллом закон распределения молекул по скоростям и все вытекающие из него следствия справедливы только для газа, находящегося в равновесии. Закон справедлив для любого числа молекул N, если только это число достаточно велико. Закон Максвелла - статистический, а законы статистики выполняются тем точнее, чем к большему числу одинаковых объектов они применяются. При малом числе объектов могут наблюдаться значительные отклонения от предсказанной статистики - флуктуации.
Экспериментальное определение распределения скоростей молекул было осуществлено впервые О. Штерном в 1920 г. Исследовалось распределение по скоростям одноатомных молекул паров металлов (Ag или Pt), из которых была изготовлена нить, расположенная на оси двух цилиндров. Нить нагревалась электрическим током, и металл испарялся (см. рис.).
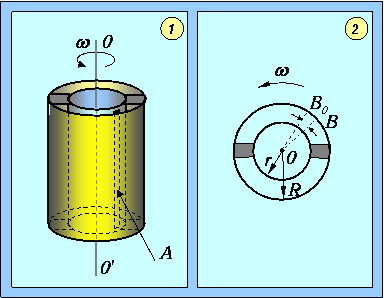
Схема опыта Штерна: 1 - вид установки сбоку; 2 - вид установки сверху
Молекулы, прошедшие через щель во внутреннем цилиндре, летели по прямой и оседали на стенке холодного внешнего цилиндра. Если привести всю установку во вращение (щель все время против точки В0), то молекулы, обладающие большой скоростью v, попадут в некоторую точку вблизи В0, а более медленные затратят на путь больше времени и попадут в точки, отстоящие дальше от В0. Следует обратить внимание, что вылетающие молекулы движутся по прямой, они не участвуют во вращательном движении. Поскольку молекулы в зависимости от скорости попадают в разные точки внешнего цилиндра, то исследуя толщину слоя металла, осевшего на его стенку, можно составить представление о распределении молекул по скоростям.
Найдем распределение молекул по расстояниям S от точки В0 до места их попадания на стенку цилиндра. Если R и r - радиусы большого и малого цилиндров, соответственно (см. рис.), то время полета от щели до стенки цилиндра
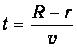
За это время цилиндр повернется на угол
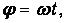
где w - угловая скорость вращения установки. Соответственно, точка попадания будет смещена относительно В0 на расстояние
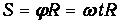
Подставляя сюда время полета, получаем связь скорости молекулы с расстоянием S:
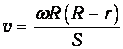
Подставляя в свою очередь полученное выражение в распределение Максвелла и учитывая, что

находим распределение молекул по расстояниям S:
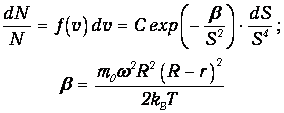
(мы опускаем выражение для нормировочной постоянной С).
Опыты Штерна подтвердили справедливость закона, установленного Максвеллом.
Поиск по сайту: