 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Кинетика радикальной полимеризации
Рассмотрим кинетику стационарного состояния реакции полимеризации, когда число возникающих свободных радикалов равно числу макрорадикалов, исчезающих в результате реакции рекомбинации. В этих условиях можно принять, что скорость реакции инициирования (V  ) равна скорости обрыва радикалов (V
) равна скорости обрыва радикалов (V 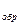 ).
).
(V  ) = (V
) = (V 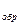 )
)
1.Стадия инициирования.
I  2 R·
2 R·
V  = К
= К  ∙[ I ], где
∙[ I ], где
V  - скорость реакции инициирования;
- скорость реакции инициирования;
К  - константа скорости образования активных центров.
- константа скорости образования активных центров.
2.Стадия роста цепи.
~М· + М  ~М – М·
~М – М·
Скорость реакции прямо пропорциональна концентрации реагирующих веществ.
V 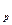 = К
= К 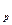 ∙ [ М∙ ] ∙ [ М ]
∙ [ М∙ ] ∙ [ М ]
К 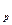 - константа скорости роста цепи;
- константа скорости роста цепи;
V 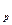 - скорость роста цепи;
- скорость роста цепи;
М – концентрация мономеров;
[ М∙ ] – концентрация активных центров.
Суммарная скорость реакции полимеризации равна скорости роста цепи. Общая скорость равна скорости роста цепи.
3. Стадия обрыва цепи.
~М· + . М~  ~М – М~ (рекомбинация)
~М – М~ (рекомбинация)
V 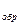 = К
= К 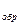 · [ М∙ ]
· [ М∙ ] 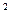 , где
, где
V 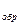 - скорость обрыва цепи;
- скорость обрыва цепи;
К 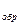 - константа обрыва цепи.
- константа обрыва цепи.
Из предположения, что скорость инициирования равна скорости образования, запишем равенство:
V 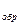 = V
= V 
К  ∙[ I ] = К
∙[ I ] = К 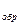 · [ М∙ ]
· [ М∙ ] 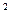
Подставляя значение [ М∙ ] в выражение для скорости роста цепи, приходим к следующим уравнениям:
[ М∙ ] = 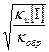 (1)
(1)
V  = V
= V  = К
= К 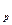
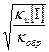 ∙ [ М ], если К
∙ [ М ], если К 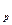
 ·[ М ] = К′
·[ М ] = К′ 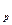 , тогда
, тогда
V  = V
= V  = К′
= К′ 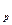 ∙
∙ 
Таким образом, суммарная скорость полимеризации возрастает пропорционально квадратному корню из концентрации инициатора.
Средняя степень полимеризации ( ) образующегося полимера определяется соотношением скорости роста цепи и обрыва цепи:
) образующегося полимера определяется соотношением скорости роста цепи и обрыва цепи:
V  К
К 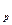 ∙ [ М∙ ] ∙ [ М ]
∙ [ М∙ ] ∙ [ М ]
 = ——— = ———————— (2)
= ——— = ———————— (2)
V 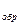 К
К 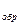 · [ М∙ ]
· [ М∙ ] 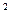
Подставим из уравнения (1) значение концентрации [ М∙ ] в уравнение (2) и получим выражение:
К 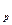 ∙ [ М ] К
∙ [ М ] К 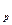 ∙ [ М ] ∙
∙ [ М ] ∙  К′
К′
 = ————— = ——————— = —— = К′
= ————— = ——————— = —— = К′ 

К 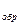
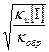 К
К 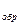 ∙
∙  ∙
∙ 

Средняя степень полимеризации изменяется обратно пропорционально квадратному корню из концентрации инициатора.
 = К′
= К′ 

Поиск по сайту: