 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Атом водорода. Атом водорода состоит из протона и электрона
Атом водорода состоит из протона и электрона. Рассмотрим движение электрона в электростатическом поле протона (протон в атоме водорода считаем неподвижным). Потенциальная энергия электрона
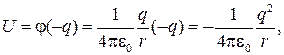
где q — заряд электрона; r — расстояние между электроном и протоном;  — потенциал, создаваемый протоном на расстоянии r от него.
— потенциал, создаваемый протоном на расстоянии r от него.
В случае атома водорода уравнение Шредингера следует записать в сферических координатах. Решение этого уравнения дает следующие квантовые значения механической энергии электрона в атоме:
 (84.1)
(84.1)
где n = 1, 2, 3, … — квантовое число, называемое главным квантовым числом; m и q — масса и заряд электрона.
Кроме того, из решения уравнения Шредингера оказывается, что момент импульса электрона в атоме квантуется по формуле
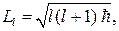 (84.2)
(84.2)
где l = 0, 1, 2, …, (n – 1) — орбитальное квантовое число. Состояние электрона, обладающего различными значениями орбитального квантового числа, в атомной физике принято обозначать и называть следующим образом:
l = 0 s -состояние;
l = 1 p -состояние;
l = 2 d -состояние;
l = 3 f -состояние
и так далее в порядке названия букв латинского алфавита.
Рассмотрим более подробно s -состояние электрона в атоме водорода при n = 1. Такое состояние электрона и атома называют основным. Волновая функция электрона в этом состоянии является функцией только r: ψ = ψ®.
Уравнение Шредингера для основного состояния атома водорода имеет вид
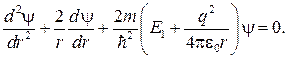 (84.3)
(84.3)
Его общее решение запишем в виде
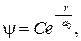 (84.4)
(84.4)
где C и a 0 — постоянные. Продифференцируем выражение (84.4):
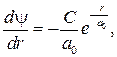 (84.5)
(84.5)
 (84.6)
(84.6)
Подставляя формулы (84.4)–(84.6) в уравнение (84.3), получаем
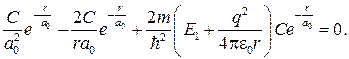
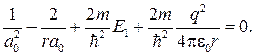
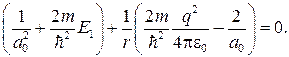
Так как последнее соотношение должно быть справедливо для любых r, то оба слагаемых в скобках в отдельности должны равняться нулю. Можем написать
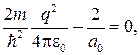
откуда
 (84.7)
(84.7)
Можем написать
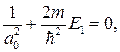
откуда с учетом формулы (84.7) получаем
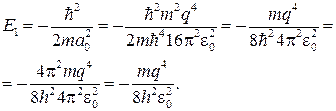 (84.8)
(84.8)
Сравнение выражений (84.1) и (84.8) показывает, что мы получили значение энергии основного состояния атома водорода, соответствующее n = 1.
Поиск по сайту: