 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Обратимые и необратимые реакции. Состояние химического равновесия
Химические реакции могут быть подразделены на необратимые и обратимые. Необратимые реакции протекают в направлении превращения реагентов в продукты реакции до тех пор, пока хотя бы один из реагентов не прореагирует количественно. Примером необратимых процессов могут служить следующие реакции:
2KClO3 = 2KCl + 3O2,
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Обратимые реакции способны протекать одновременно в двух противоположных направлениях; в случае таких процессов взаимодействие исходных веществ приводит к образованию продуктов реакции (прямая реакция), которые, способны взаимодействовать друг с другом с образованием исходных веществ (обратная реакция). К таким реакциям можно отнести взаимодействие азота с водородом:
N2 + 3H2  2NH3
2NH3
Заметим, что многие реакции, кажущиеся необратимыми, фактически таковыми не являются. Например, реакция осаждения сульфата бария или реакция нейтрализации
Ba2+ + SO 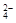 = BaSO4↓,
= BaSO4↓,
H+ + OH- = H2O
являются, строго говоря, обратимыми, так как сульфат бария в какой-то мере растворим, а вода, пусть крайне незначительно, но все же диссоциирует на ионы водорода и гидроксила. О таких реакциях говорят, что они практически необратимы.
Пусть в системе протекает обратимая гомогенная одностадийная реакция
aA + bB  dD + eE
dD + eE
Кинетические уравнения, отвечающие этой реакции, имеют вид:
 (прямая реакция),
(прямая реакция),
 (обратная реакция)
(обратная реакция)
Если смешать некоторые количества веществ А и В, то в первый момент скорость прямой реакции будет максимальна, а скорость обратной реакции будет равна нулю, так как веществ D и Е в системе нет. По мере образования веществ D и Е скорость прямой реакции будет уменьшаться, а скорость обратной реакции - увеличиваться. В конце концов, скорость прямой реакции станет равна скорости обратной реакции, после чего изменение концентраций реагентов и продуктов реакции прекратится: в единицу времени будет образовываться столько молей D и Е, сколько молей этих веществ будет превращаться в А и В.
Состояние системы, в котором скорости прямой и обратной реакции равны, называется химическим равновесием.
Концентрации реагентов и продуктов реакции, при которых система находится в состоянии равновесия, называются равновесными концентрациями. Равновесные концентрации обычно обозначают, заключая формулу соответствующего соединения в квадратные скобки.
Если система находится в состоянии равновесия (v1=v2), то.
k1[A]a[B]b = k2[D]d[E]e,
откуда

Отношение констант скорости есть величина постоянная, не зависящая от концентрации. Эта величина называется константой равновесия

Таким образом, для системы, находящейся в состоянии равновесия, отношение произведения концентраций продуктов реакции к произведению концентраций реагентов является постоянной величиной, называемой константой равновесия. Константа равновесия не зависит от концентраций, но зависит от природы реагирующих веществ и температуры. Заметим, что любое равновесие может устанавливаться при различных значениях равновесных концентраций. Необходимо лишь, чтобы выражение 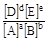 равнялось константе равновесия вне зависимости от того, чему равны величины [A], [B], [D] и [E].
равнялось константе равновесия вне зависимости от того, чему равны величины [A], [B], [D] и [E].
Если реакция протекает между газообразными веществами, то концентрации взаимодействующих веществ могут быть заменены парциальными давлениями газов, так как давление газа пропорционально его концентрации. В этом случае

Поскольку, согласно уравнению состояния идеального газа,
 ,
,
численные значения К и К′ будут различными.
Пусть реакция
А + 2В  АВ2
АВ2
протекает в две стадии
А + В  АВ;
АВ; 
AB + B  AB2;
AB2; 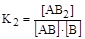
Найдем произведение констант равновесия реакций:
 = К
= К
Произведение К1.К2 есть константа равновесия реакции К, рассчитанная в предположении, что эта реакция одностадийна. Таким образом, независимо от числа промежуточных стадий стехиометрические коэффициенты уравнения реакции входят в уравнение константы равновесия как показатели степени при соответствующих концентрациях. Так, реакция
N2 + 3H2  2NH3
2NH3
явно не может быть одностадийной, однако для нее
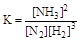
Пусть вещества В и Е являются кристаллическими.
aA + bB(кр.)  dD + eE(кр.)
dD + eE(кр.)
Тогда скорости прямой и обратной реакции будут пропорциональны не концентрациям, а площадям поверхностей (S) веществ В и Е:
 ,
,

В состоянии равновесия площади поверхности SВ и SЕ будут постоянны и войдут в значение константы равновесия. Отсюда для гетерогенного процесса

Таким образом, уравнение закона действующих масс применимо и для гетерогенных процессов, но концентрации веществ, образующих индивидуальную фазу, в него не включаются. Например, для реакции
СаСО3(к)  СаО(к) + СО2(г)
СаО(к) + СО2(г)
K = [CO2]
т.е. равновесие устанавливается тогда, когда концентрация (или прациальное давление) диоксида углерода достигает определенного значения.
Еще раз подчеркнем, что установление химического равновесия отнюдь не означает, что в системе прекращается протекание прямой и обратной реакций. Эти реакции продолжают протекать, но с одинаковой скоростью. Химическое равновесие, таким образом, является динамическим, т.е. подвижным.
Рассмотрим термодинамические условия установления состояния равновесия. Химическое равновесие всегда устанавливается самопроизвольно и, следовательно, является состоянием, наиболее устойчивым в данных условиях. Независимо от того, скорость какого процесса, прямого или обратного, преобладает в неравновесной системе, переход к равновесию сопровождается понижением свободной энергии Гиббса. Отсюда следует, что в состоянии равновесия энергия Гиббса принимает минимальное значение. Это значение G будет сохраняться, пока равновесие не будет нарушено. Отсюда следует, что пока система пребывает в состоянии равновесия, ΔG для нее равно нулю. Константа равновесия связана с изменением энергии Гиббса уравнением
 ,
,
где 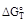 - изменение энергии Гиббса при температуре Т, стандартном давлении и концентрациях веществ, участвующих во взаимодействии, равных 1 моль/л.
- изменение энергии Гиббса при температуре Т, стандартном давлении и концентрациях веществ, участвующих во взаимодействии, равных 1 моль/л.
Поиск по сайту: