 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Ионные радиусы
Структурные типы ионных кристаллических решеток весьма разнообразны. Несколько наиболее часто встречающихся структур рассмотрены ниже.
1. Структурный тип хлорида цезия. Одноименные ионы занимают позиции в восьми вершинах куба, в центре которого находится ион противоположного знака. Таким образом, в кристалле хлорида цезия каждый ион окружен восьмью ионами хлора, а каждый ион хлора - восьмью ионами цезия (рис. 23,а). Координационное число (КЧ) как катиона, так и аниона в подобных решетках равно восьми.
2. Структурный тип хлорида натрия. В кристалле хлорида натрия ионы Na+ и Cl- образуют взаимопроникающие кубические гранецентрированные решетки, в которых одинаковые ионы находятся в вершинах куба и в центре граней этого куба. В подобной решетке каждый ион окружен шестью ионами противоположного знака, образующими октаэдр. КЧ обоих ионов в решетке хлорида натрия равно 6 (рис. 23,б).
3. Структурный тип сфалерита. Сфалерит - минерал, представляющий одну из модификаций сульфида цинка ZnS. В решетке сфалерита каждый ион цинка окружен четырьмя ионами серы, образующими тетраэдр, и наоборот (рис. 23,в). Таким образом, для решеток типа сфалерита КЧ как катиона, так и аниона равно четырем.
4. Структурный тип флюорита. В кристалле фторида кальция (минерал флюорит) восемь ионов фтора образуют куб вокруг каждого иона кальция (КЧCa2+ = 8), а четыре иона кальция образуют тетраэдр вокруг каждого иона фтора (КЧF- = 4) (рис. 23,г). Если поменять число и позиции катионов и анионов, то полученная решетка называется структурой типа антифлюорита. Такую структуру имеет, например, оксид лития Li2O.
5. Структурный тип рутила. Минерал рутил является одной из модификаций диоксида титана. В кристалле рутила координационное число катиона равно шести; шесть ионов кислорода, окружающих ион титана, образуют почти правильный октаэдр. Координационное число аниона равно трем; три катиона титана располагаются в вершинах равнобедренного треугольника вокруг иона кислорода (рис. 23,д).
Теория ионной связи рассматривает расстояние между соседними ядрами катиона и аниона в решетке ионного соединения как сумму эффективных радиусов катиона и аниона
r = r+ + r-
Значение r может быть установлено экспериментально методами рентгеноструктурного анализа. Для определения значений r+ и r- при известном значении r измеряют электронную плотность кристалла, а затем делят межъядерное расстояние на два отрезка в точке, для которой электронная плотность минимальна. Так, например, для кристалла хлорида натрия межъядерное расстояние равно 283 пм, а минимум на кривой электронной плотности приходится на точку, отстоящую от ядра иона Nа+ на 116 пм, а от ядра иона Cl- на 167 пм. Эти величины и выбирают в качестве эффективных радиусов катиона натрия и хлорид-аниона.
Ионные радиусы очень мало зависят от природы партнера соответствующего иона, однако на них существенно влияет координационное число иона в кристаллической решетке. В табл. 19 приведены значения ионных радиусов натрия и фтора для различных координационных чисел.
Таблица 19
Ионные радиусы (пм) ионов Na+ и F- при различных значениях
координационных чисел
| Ион | Координационное число | |||||
| Na+ | - | - | ||||
| F- | 114,5 | - | - |
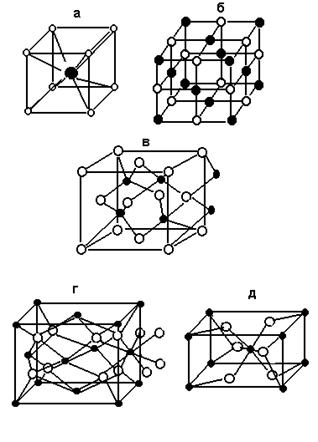
Рис. 23. Некоторые распространенные структуры ионных кристаллов:
а - CsCl, б - NaCl, в - ZnS (сфалерит), г - CaF2 (флюорит), д - TiO2 (рутил);
· - металл, o - неметалл
Как следует из табл. 19, с увеличением координационного числа увеличиваются эффективные радиусы как катионов, так и анионов. Это явление может быть объяснено возрастанием сил отталкивания с увеличением числа одноименных ионов, образующих ближайшее окружение. Для катионов на величину ионного радиуса существенно влияет заряд иона: с увеличением заряда притяжение между катионом и анионом растет, а ионный радиус уменьшается. Так, для ионов Fe2+ и Fe3+ при координационном числе, равном 6, ионные радиусы равны 75 и 69 пм.
Важной характеристикой ионного кристалла является отношение ионных радиусов r+/r-, в значительной мере определяющее тип структуры соединения. Так, для кубических решеток при значении r+/r- от 0,41 до 0,73 обычно реализуется структурный тип хлорида натрия с координационным числом 6. Если значения r+/r- укладываются в интервал 0,73 - 1,37, более предпочтительной оказывается решетка типа хлорида цезия с координационным числом 8. Для значений r+/r-, изменяющихся в пределах от 0,23 до 0,41, наиболее типичным оказывается структурный тип сфалерита с координационным числом 4. Например, значения отношений r+/r- для иодидов цезия и меди(I) равны соответственно 0,89 и 0,38, откуда можно предсказать для CsI структуру типа хлорида цезия, а для CuI - структуру типа сфалерита. Эти структуры действительно присущи указанным соединениям. Однако известны ионные соединения, нарушающие сформулированные выше правила.
Поиск по сайту: