 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Задача № 3. В воде массой 500 г растворили металлический натрий массой 2,3 г
В воде массой 500 г растворили металлический натрий массой 2,3 г. Рассчитайте молярную концентрацию вещества в полученном растворе, если его плотность равна 1,09 г/мл.
Решение:
1. При растворении металлического натрия в воде протекает химическая реакция, в результате которой образуется гидроксид натрия и выделяется водород:
2Na + 2H2O = 2NaOH + H2.
Следовательно, необходимо найти молярную концентрацию NaОН в растворе:  .
.
2. Определяем количество вещества металлического натрия: 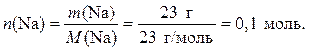
Исходя из уравнения химической реакции рассчитываем количество вещества NaOH: n (NaOH) = n (Na) = 0,1 моль.
3. Вычисляем массу полученного раствора и его объем:
m (р-ра) = m (Н2О) + m (Na) – m (Н2);
n (Н2) = 1/2 n (Na) = 0,05 моль;
m (Н2) = 0,05 моль × 2 г/моль = 0,1 г;
m (р-ра) = 500 + 2,3 – 0,1=502,2 г.

4. Рассчитываем молярную концентрацию NaОН в полученном растворе:

Ответ: 0,217М.
Упражнения и задачи для самостоятельного решения.
1. В 200 мл раствора хлорида бария содержится 52 г соли. Определите молярную концентрацию соли в растворе. (Ответ: 1,25М)
2. Какая масса хлорида натрия необходима для приготовления 1,5 л раствора с молярной концентрацией хлорида натрия (NaCl) 0,25 моль/л? (Ответ: 21,94 г)
3. В 500 мл раствора медного купороса (СuSO4×5Н2О) содержится 75 г пентагидрата сульфата меди(II). Какова молярная концентрация пентагидрата сульфата меди(II) в растворе? (Ответ: 0,6М)
4. В каком объеме раствора соляной кислоты, с концентрацией 0,25М, содержится 27,375 г хлороводорода? (Ответ: 3 л)
5. Сколько мл 2,5М раствора азотной кислоты требуется для приготовления 3 л 0,75М раствора? (Ответ: 0,9 л)
6. Вычислите массовую долю фосфорной кислоты в ее растворе с концентрацией 2,5М и плотностью 1,2 г/мл. (Ответ: 20,4%)
7. К 280 г насыщенного раствора KNO3, растворимость которого при данной температуре равна 40 г/100 г Н2О, добавили 120 г воды. Определите массовую долю KNO3 в полученном растворе. (Ответ: 20%)
8. Сколько граммов раствора серной кислоты с массовой долей 10% требуется для нейтрализации 200 г раствора гидроксида калия с массовой долей 16,8%? (Ответ: 294 г)
 Дополнительные задания
Дополнительные задания
1. Определите объем 0,5М раствора СuSO4, который можно приготовить из 12,5 г CuSO4×5Н2О. (Ответ: 0,1 л)
2. Сколько мл 98%-ного раствора Н2SO4 (пл. 1,84 г/мл) необходимо взять для приготовления 500 мл 0,5М раствора? (Ответ: 13,6 мл)
3. Для нейтрализации 4,35 г кислоты, образованной высшим оксидом элемента VI группы периодической системы потребовалось 30 мл 2М раствора NaOH. Установите формулу кислоты. (Ответ: Н2SeO4)
4. К воде массой 40 г прилили ацетон объемом 100 мл и получили раствор с плотностью 0,88 г/мл. Определите объемную долю ацетона в растворе, если плотность ацетона 0,79 г/мл. (Ответ: 74%)
5. К метиловому спирту объемом 90 мл (пл. 0,8 г/мл) прилили 160 мл воды (пл. 1 г/мл) и получили раствор плотностью 0,9 г/мл. Вычислите объемную долю спирта в растворе. (Ответ: 34,9%)
6. Какой объем раствора с массовой долей карбоната натрия 0,15 (пл.
1,16 г/мл) надо взять для приготовления 120 мл раствора с концентрацией 0,45М? (Ответ: 32,9 мл)
Поиск по сайту: