 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Задача № 6. Начальные концентрации веществ в реакции СО(г)+ Н2О(г)= СО2(г)+ Н2(г) были равны (моль/л): с(СО) = 0,5; с(Н2О) = 0,6; с(СО2) = 0,4; с(Н2) = 0,2
Начальные концентрации веществ в реакции СО(г)+ Н2О(г)= СО2(г)+ Н2(г) были равны (моль/л): с (СО) = 0,5; с (Н2О) = 0,6; с (СО2) = 0,4; с (Н2) = 0,2. Вычислите концентрацию всех участвующих в реакции веществ после того, как прореагировало 60% воды.
Решение:
1. Примем объем системы за 1 литр, тогда количество веществ в начальный момент времени равно их концентрации. Определяем количество воды, которая вступила в реакцию, учитывая, что прореагировало 60%:
n (Н2О) = 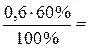 0,36 моль.
0,36 моль.
2. Определяем количество СО, которое вступило в реакцию с водой:
по уравнению реакции n (СО) = n (Н2О); n (СО) = 0,36 моль.
3. Вычисляем количество реагентов СО и Н2О, оставшееся в системе после реакции:
nост = nисх – n прореаг;
n (СО)ост = 0,5 – 0,36 = 0,14 моль;
n (Н2О)ост = 0,6 – 0,36 = 0,24 моль.
4. Находим количество образовавшихся продуктов реакции:
по уравнению n (СО2) = n (Н2) = n (Н2О);
n (Н2)обр = 0,36 моль; n (СО2) обр = 0,36 моль.
5. Определяем количество продуктов реакции в системе к моменту окончания реакции: n = n исх + n обр;
n (СО2) = 0,4 + 0,36 = 0,76 моль; n (Н2) = 0,2 + 0,36 = 0,56 моль.
Так как объем системы принят за 1 литр, то концентрации веществ, участвующих в реакции численно равны их количеству:
с (СО) = 0,14; с (Н2О) = 0,24; с (СО2) = 0,76; с (Н2) = 0,56 моль/л.
Ответ: с (СО) = 0,14; с (Н2О) = 0,24; с (СО2) = 0,76; с (Н2) = 0,56 моль/л.
Упражнения и задачи для самостоятельного решения.
1. Напишите выражение закона действующих масс (кинетические уравнения) для следующих реакций, предварительно расставив коэффициенты, предполагая, что они являются простыми:
NO + O2 ® NO2; NO+Cl2 ® NOCl2; Fe + Cl2 ® FeCl3;
Fe2O3 + H2 ® Fe + H2O; CO2 + C ® CO;
CaO + СО2 ® CaCO3; CaCO3 ® CaO + CO2.
2. В результате некоторой реакции в единице объема в единицу времени, образовалось 3,4 г аммиака, а в результате другой реакции в тех же условиях – 3,4 г фосфина. Одинаковы ли скорости этих реакций?
3. Определите среднюю скорость химической реакции СО2+Н2=СО+Н2О, если через 80 сек. после начала реакции молярная концентрация паров воды была равна 0,24 моль/л, а через 2 мин. 07 сек. стала равна
0,28 моль/л. (Ответ: 8,5×10–4 моль/л×с)
4. Как изменится скорость прямой одностадийной реакции
2НI(г) Н2(г) + I2(г), если концентрацию йодоводорода увеличить в
3 раза? (Ответ: увеличит в 9 раз)
5. Во сколько раз изменится скорость реакции НВr + HВrO ® Br2+H2O при разбавлении реагирующей смеси в 6 раз?
(Ответ: уменьшить в 36 раз)
6. На сколько градусов надо повысить температуру газообразных реагирующих веществ, чтобы скорость реакции увеличилась в 125 раз, если температурный коэффициент равен 5? (Ответ: на 30о)
7. Во сколько раз следует увеличить концентрацию кислорода, чтобы при одновременном понижении температуры на 30оС (g =2) скорость реакции: 2СО+О2 = 2СО2 осталась неизменной? (Ответ: 8 раз)
 Дополнительные задания
Дополнительные задания
1. Как изменится скорость прямой реакции 2NO+O2 2NO2, если давление в системе увеличить в 3 раза, а температуру оставить неизмененной? (Ответ: увеличить в 27 раз)
2. Растворение образца железа в серной кислоте при 20оС заканчивается через 15 мин., а при 30оС такой же образец металла растворяется за
6 мин. За какое время данный образец железа растворяется при 35оС? (Ответ: 3,8 мин.)
3. Рассчитайте, как изменится скорость реакции:
Fe3O4 + H2 ® Fe + H2O при
а) повышении концентрации исходного вещества в 3 раза;
б) повышении давления в 2 раза;
в) понижении температуры на 30о (g = 3).
Предварительно расставьте коэффициенты в уравнении реакции.
(Ответ: а) 81 раз, б) 16 раз, в) 27 раз)
4. Во сколько раз следует уменьшить концентрацию оксида азота(II), чтобы при одновременном увеличении концентрации кислорода в 9 раз скорость реакции 2NO+O2 ® 2NO2 осталась неизменной?
(Ответ: 3 раза)
5. При температуре 100оС реакция идет 60 мин. Сколько времени идет эта же реакция при 70оС, если температурный коэффициент равен 3? (Ответ: 27 часов)
6. Как изменится скорость обратимой химической реакции
2NO+О2 2NO2, если увеличить давление в 4 раза?
(Ответ: скорость прямой реакции больше скорости обратной в 4 раза)
Поиск по сайту: