 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Занятие 9. Вывод формул химических соединений
G Повторите. Что означает простейшая (эмпирическая), истинная, молекулярная формулы вещества; какие данные необходимы для вывода простейших и истинных формул
Типовые задачи с решениями
I тип. Вывод формул по массовым долям элементов, входящих в состав молекулы.
Задача
Определить молекулярную формулу оксида фосфора, содержащего 43,7% фосфора. Плотность по воздуху паров этого оксида 9,8.
Решение:
1. Обозначим простейшую формулу РxOy, молекулярную (PxOy) p.
2. Примем массу оксида m (PxOy)=100г, тогда m (P)= m (оксида) w(P)=43,7г; m (O)=100– m (P)=100–43,7=56,3 г.
3. Находим количества веществ атомарных фосфора и кислорода:
n =  ; n (P)=
; n (P)=  =1,41 моль; n (O)=
=1,41 моль; n (O)=  =3,52 моль.
=3,52 моль.
4. Находим отношение числа атомов элементов в химическом соединении, т.е. простейшую формулу: х: у: = п (Р): п (О) = 1,41: 3,52 = 1: 2,5.
Так как в формулах соединений индексы должны быть целыми числами, то правую часть равенства умножаем на 2:
n (P): n (O)=2: 5, следовательно, простейшая формула P2O5.
Атомному соотношению 2: 5 соответствуют формулы (Р2О5) р, где р = 1,2,3 …
5. Для нахождения р вычислим молярную массу соединения по относительной плотности: М (Р2О5)р = 29×Двозд.= 29 г/моль×9,8 = 284 г/моль.
р = 
Следовательно, молекулярная формула оксида (Р2О5)2 или Р4О10.
Ответ: Р4О10.
II тип. Вывод формул химических соединений по продуктам сгорания веществ.
Задача
При сжигании 0,46 г вещества получено 0,448 л (н.у.) оксида углерода(IV) и 0,54 г воды. Плотность паров этого вещества по водороду 23. Выведите молекулярную формулу этого вещества.
Решение:
1) Устанавливаем элементный состав вещества. Поскольку при сгорании вещества в кислороде образуются СО2 и Н2О, то в состав вещества, кроме углерода и водорода, может входить и кислород.
Определим, входит ли в состав вещества кислород.
2) Находим количество вещества углерода и водорода, входящих в состав соединения:
СО2 ® С; 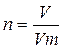 ; n (С) = n (СО2) =
; n (С) = n (СО2) =  ;
;
n (С) = n (СО2) = 0,02 моль;
Н2О ® 2Н;  ;
;  =
=  ;
;
n (Н) = 2 n (Н2О) = 2×  = 0,06 моль.
= 0,06 моль.
3) Рассчитываем массу кислорода, входящего в состав вещества:
m (О) = m (в-ва) – m (С) – m (Н) = 0,46-0,02×12 – 0,06×1 = 0,16 г.
4) Определяем количество вещества кислорода:
n (О) =  = 0,01 моль.
= 0,01 моль.
5) Таким образом СхНуОz – простейшая формула; (СхНуОz)р – молекулярная формула.
6) Находим атомное соотношение элементов в веществе:
х: у: z = n (С): n (Н): n (О) = 0,02: 0,06: 0,01 = 2: 6: 1.
C2H6O – простейшая формула.
Для нахождения «р» воспользуемся дополнительным условием:
М (вещества) =2×D(Н2) = 2 г/моль×23 = 46 г/моль,
следовательно, 46 р = 46; р = 1.
С2Н6О – истинная формула.
Ответ: С2Н6О.
III тип. Вывод формул химических соединений по объемным отношениям реагирующих газообразных веществ.
Задача
При сжигании смеси, состоявшей из двух объемов неизвестного газа и полутора объемов кислорода, образовалась смесь из одного объема азота и трех объемов водяного пара. Во всех случаях объемы газов измерены при одинаковых условиях.
Решение:
Так как при сгорании неизвестного газа в кислороде образуются N2 и Н2О, то в состав газа входят азот, водород и возможно кислород: NхНуОz.
Согласно закону объемных отношений объемы газов пропорциональны их количествам и равны коэффициентам в уравнении реакции.
Запишем уравнение реакции: 2NxHуОz + 3/2О2 = N2 + 3Н2О(пар).
По закону сохранения массы веществ число атомов элементов в левой и правой частях уравнения равно:
2х = 2; х = 1;
2у = 6; у = 3;
2z + 3 = 3; z =0.
Следовательно, формула неизвестного газа NH3.
Ответ: NH3.
IV тип. Вывод формул кристаллогидратов.
Задача
Выведите формулу кристаллогидрата фосфата цинка, если известно, что массовая доля соли в нем равна 84,2%.
Решение:
1 способ:
Пусть в состав кристаллогидрата входит п молекул воды, т.е. формула кристаллогидрата Zn3(РО4)2× n Н2О.
w(Zn3(РО4)2) =  ×100%;
×100%;
М (Zn3(PO4)2) = 385 г/моль;
М (кристаллогидрата) = 
457 = 385 + 18 n; n = 4.
Следовательно, формула кристаллогидрата Zn3(PO4)2×4Н2О.
Поиск по сайту: