 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Уравнение Шредингера для атома водорода
Данное уравнение имеет следующий вид:
 (II.98)
(II.98)
Или в сферических координатах:
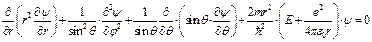 (II.99)
(II.99)
представим волновую функцию в виде произведения радиальной и угловой частей и подставим в уравнение (II.99)

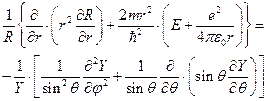 (II.100)
(II.100)
Приравняем левую и правую часть уравнения (II.100) одной и той же величине – 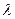 . Получим два уравнения – одно для радиальной части и другое для угловой части:
. Получим два уравнения – одно для радиальной части и другое для угловой части:
 (II.100 а)
(II.100 а)
 (II.100 б)
(II.100 б)
полагаем, что  и тогда уравнение (II.100 а) такое же, как для жесткого ротатора. Таким образом, имеем
и тогда уравнение (II.100 а) такое же, как для жесткого ротатора. Таким образом, имеем 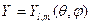 и
и 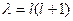 .
.
решение уравнения (II.100 б) аналогично решению уравнения для гармонического осциллятора. Энергия n-го уровня
 , n=1,2,3… … (II.101)
, n=1,2,3… … (II.101)
a0 – радиус первой боровской орбиты, a0 = 0,529177 Å.
Сферические гармоники или угловые части 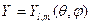 выражаются, как и для жесткого ротатора через присоединенный полином Лежандра. Радиальные функции
выражаются, как и для жесткого ротатора через присоединенный полином Лежандра. Радиальные функции 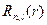 выражаются через функции Лагерра
выражаются через функции Лагерра 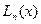 . Эти функции для функции
. Эти функции для функции 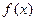 имеют вид:
имеют вид:
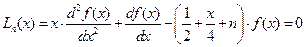 (II.102)
(II.102)
Таким образом, мы имеем решение стационарного уравнения Шредингера для атома водорода в виде произведения угловой и радиальной частей, которые принято называть атомными орбиталями или АО. Они записываются как функции трех переменных с тремя индексами  - АО.
- АО.
n – главное квантовое число и оно определяет энергию электрона
l – орбитальное квантовое число и оно определяет форму атомной орбитали
m – магнитное квантовое число и оно определяет в пространстве направление атомной орбитали
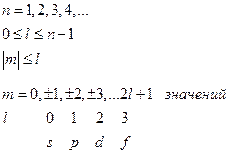 (II.103)
(II.103)
Волновые функции атома водорода представляют собой основные структурные единицы при построении молекулярных волновых функций. При этом важны даже не сами водородные функции, а функции родственного типа для так называемых водородоподобных атомов, которые мы и рассмотрим подробнее на конкретных примерах. Но прежде определим, какие же атомы называются водородоподобными.
Водородоподобные атомы – это системы, состоящие из ядра с Z протонами и одного электрона. То есть это атомы с зарядом [(Z-1)e]+.
Напишем несколько функций для водородоподобных атомов в явном виде. Сначала напишем их для радиальной части для нескольких значений l и m
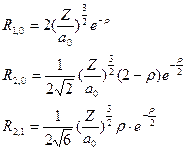 , (II.104)
, (II.104)
где 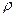 – безразмерный параметр,
– безразмерный параметр, 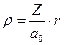 , а первый и второй индексы при R обозначают l и m, соответственно.
, а первый и второй индексы при R обозначают l и m, соответственно.
Максимальное количество орбиталей на энергетическом уровне или кратность вырождения определяется по формуле 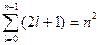 .
.
Угловые части АО выглядят следующим образом:
s – АО 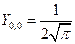
p – AO  (II.105)
(II.105)
d – AO 
Неудобством таких угловых функций является то, что среди них встречаются комплексные функции, которые нельзя изобразить в действительном пространстве. Однако из них можно получить удобные действительные функции – атомные орбитали, составляя линейные комбинации сферических гармоник с одинаковым квантовым числом l и одинаковым значением m.
Например, рассмотрим линейную комбинацию:
 (II.106)
(II.106)
Подставим последние две формулы в выражение для px:

Аналогичным способом можно построить две другие атомные орбитали с l = 1, обозначения которых также понятны:
 (II.107)
(II.107)
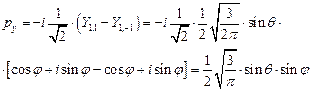 (II.108)
(II.108)
Так же можно перейти от комплексных угловых функций для n=2 - 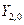 ,
, 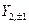 ,
, 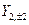 к действительным АО, обозначаемым как
к действительным АО, обозначаемым как  , соответственно.
, соответственно.
Теперь вспомним, что атомные орбитали получаются в результате перемножения угловой и радиальной частей. И выпишем несколько нормированных волновых функций водородоподобного атома:
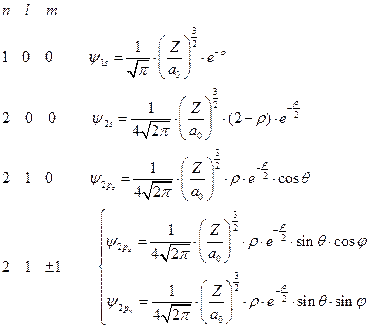
(II.109)
В химических приложениях часто используют графическое изображение волновых функций, причем, как правило, отдельно изображаются радиальная и угловая части. Выделяют только ту часть, которая зависит только от угловых переменных 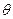 и
и  . Она имеет смысл полного выражения для АО, в котором условно принимают, что АО является произведением некоторой радиальной функции и определенной функции, зависящей от углов
. Она имеет смысл полного выражения для АО, в котором условно принимают, что АО является произведением некоторой радиальной функции и определенной функции, зависящей от углов 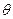 и
и  . Например, для 2pz атомной орбитали эта функция имеет следующий вид:
. Например, для 2pz атомной орбитали эта функция имеет следующий вид: 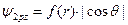 . Ее в учебниках химии изображают в виде гантели, вытянутой вдоль оси Оz, как это показано на Рис. 6 а. На Рис.6 б и в показаны 2py и 2px атомные орбитали.
. Ее в учебниках химии изображают в виде гантели, вытянутой вдоль оси Оz, как это показано на Рис. 6 а. На Рис.6 б и в показаны 2py и 2px атомные орбитали.
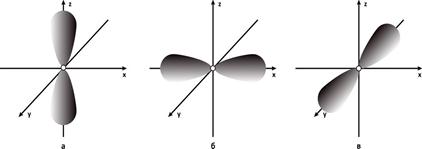
Рис.6. Электронные облака p – орбиталей: а - 2pz- АО, б - 2py- АО, в - 2px- АО.
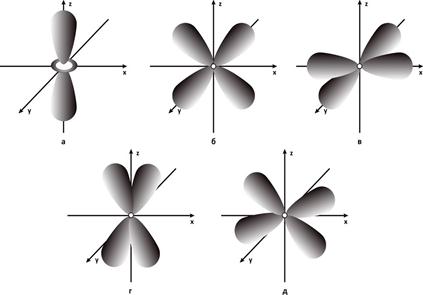
Рис.7. Электронные облака d – орбиталей: а - 3dz2-АО; б - 3dxz-АО; в - 3dx2-y2-АО; г - 3dyz-АО; д - 3dxy-АО.
На Рис. 7 приведено схематическое изображение d- АО, точнее их угловых частей. АО с главным квантовым числом 3 называются f – орбиталями. Они выглядят еще сложнее и изображать их графически достаточно трудно.
Здесь необходимо сделать одно важное замечание – широко используемые в химии атомные орбитали: s, p, d и т.д. являются, прежде всего, решениями стационарного уравнения Шредингера для атома водорода и водородоподобных атомов. И, наверное, благодаря тому, что атомы в значительной мере сохраняют свои свойства при образовании молекул, атомные орбитали явились очень плодотворной математической моделью, имеющей глубокое физическое значение при описании физико-химических свойств множества молекул. Не стоит забывать также и то, что, изображенные на Рис. 6 и 7 электронные облака, прежде всего, означают вероятность распределения в пространстве электронной плотности.
Поиск по сайту: