 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ИНИЦИИРОВАНИЕ РАДИКАЛЬНОЙ ПОЛИМЕРИЗАЦИИ
Образование свободных радикалов возможно при действии химических и физических факторов, поэтому инициирование радикальной полимеризации подразделяют на физическое и химическое (смотри схему)

В технологии производства полимеров преимущественно распространены химические методы инициирования, когда в реакционную смесь вводят инициаторы (J)- вещества, которые в определенных условиях легко распадаются на радикалы.
В группу инициаторов входят следующие вещества (таблица 10)
Таблица 10 –Типы инициаторов радикальной полимеризации
| Тип инициатора | Формула (в общем виде) | Механизм распада на радикалы |
| Дигидропероксиды | 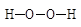
| 
|
| Алкилгидропероксиды | 
| 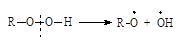
|
| Диалкилпероксиды | 
| 
|
| Диацилпероксиды | 
| 
|
| Дисульфиды | 
| 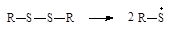
|
| Персульфаты | 
| 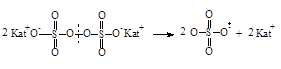
|
| Азосоединения | 
| 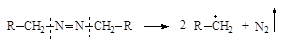
|
Конкретные представители инициаторов, условия и механизм их распада приведены в таблице 11.

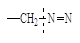
Легкий и быстрый распад инициаторов на радикалы происходит по связям кислород – кислород или углерод – азот, так как эти связи обладают наименьшей прочностью (энергией связи).
| Связь | 
| 
| 
| 
| 
|
| Энергия связи, кДж/моль |
Наименьшие температуры распада (50÷850С) и соответственно наименьшая энергия активации (Еаи) у таких инициаторов как персульфат аммония, динитрил азобисизомасляной кислоты, пероксид бензоила. Эти инициаторы чаще всего используются в радикальной полимеризации.
Окислительно-восстановительные системы (ОВ-системы) – это комплексные системы, которые включают в себя окислитель и восстановитель (промотор). Роль окислителя чаще всего играют выше приведенные инициаторы J (пероксиды, гидропероксиды и др.). Промотором называют вещество, которое ускоряет распад инициаторов на радикалы. Промоторами в ОВ-системах служат соли металлов переменной валентности в низшей степени окисления, такие как хлорид железа двухвалентного FeCl2, хлорид меди одновалентной CuCl, нафтенаты кобальта, нафтенаты никеля (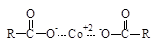 ) и др. Кроме них роль промоторов играют амины, сульфиты и др. В лакокрасочной промышленности промоторы – ускорители полимеризации называют сиккативы.
) и др. Кроме них роль промоторов играют амины, сульфиты и др. В лакокрасочной промышленности промоторы – ускорители полимеризации называют сиккативы.
 Механизм действия окислительно-восстановительных систем различен. Простейшей ОВ-системой является реактив Фентона – смесь из пероксида водорода Н-О-О-Н и хлористого железа FeCl2. В этой системе нестабильный катион Fe2+ легко теряет электрон ` е и переходит в высшую степень окисления. Fe3+. Выделившийся электрон ускоряет распад пероксида водорода Н-О-----О-Н на ион НО - и радикал НО ·.
Механизм действия окислительно-восстановительных систем различен. Простейшей ОВ-системой является реактив Фентона – смесь из пероксида водорода Н-О-О-Н и хлористого железа FeCl2. В этой системе нестабильный катион Fe2+ легко теряет электрон ` е и переходит в высшую степень окисления. Fe3+. Выделившийся электрон ускоряет распад пероксида водорода Н-О-----О-Н на ион НО - и радикал НО ·.
Распад инициаторов на радикалы в присутствии ОВ-систем идет очень быстро и энергия активации стадии инициирования при использовании ОВ-систем ниже, чем при использовании только одних химических инициаторов (Еаи (ОВ) < Еаи ( J )). Обычно энергия активации окислительно-восстановительного инициирования Еаи (ОВ) составляет 42÷84 кДж/моль, а энергия активации инициирования с применением только инициаторов Еаи ( J ) равна 112÷170 кДж/моль.
Инициирование РП, т.е. образование свободных радикалов идет в два этапа, которые схематично можно представить следующим образом:
а) образование радикалов J · в результате распада молекул инициатора J:

б) образованием активных радикалов роста J- М · из молекул мономеров М:


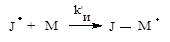
На примере мономера винилхлорида эта реакция выглядит так:
 | |||||
 | |||||
 |
Начальный этап (а) всегда требует затрат энергии активации Еаи, протекает с низкой скоростью и лимитирует весь процесс. Не все радикалы инициатора J · могут вызвать второй этап б) и образовать радикалы роста J- М ·.
Часть радикалов инициатора исчезает в результате протекания обратной реакции рекомбинации J · + J · =J2 .
Константа скорости инициирования kи при РП мала и составляет kи=0,8 ÷ 5,0 × 10-5 с-1.
Фотохимическое инициирование используется реже, чем химическое. При фотохимическом инициировании молекулы мономера М поглощают энергию квантов (hn) излучения с длиной волны 100 нм<l< 400 нм, возбуждаются и распадаются на радикалы.
Энергия активации фотохимического инициирования Еаи (ф/х) значительно ниже энергии активации чисто химического инициирования Еаи(Еаи (ф/х)<<Еаи ( J)) и близка к 0 (Еаи (ф/х)» 0 кДж/моль). Вследствие этого фотохимическая радикальная полимеризация может протекать при низких и даже отрицательных температурах.
Однако скорость распада мономеров на радикалы при действии УФ-лучей или видимого излучения (ВИ) невысока. Для ускорения фотохимической полимеризации используют 2 приема:
1. Вводят в мономер вещества – фотоинициаторы
2. Вводят в мономер вещества – фотосенсибилизаторы.
Фотоинициаторы – это вещества, которые под влиянием энергии квантов УФ- или ВИ – излучения легче распадаются на радикалы, чем сами мономеры. Фотоинициаторами служат галогеналкилы (четыреххлористый углерод ССl4, 1,2 –трихлорэтанC2Cl6), металлорганические соединения. Механизм действия ССl4 следующий:

Фотосенсибилизаторы – это вещества, которые поглощают и накапливают энергию квантов УФ- или ВИ – излучения в более широком диапазоне длин волн, чем сам мономер, затем порциями большей величины отдают накопленную энергию мономеру. Молекулы мономера быстро переходят в возбужденное состояние и распадаются на радикалы. Роль фотосенсибилизаторов играют вещества, содержащие в своей структуре сопряженную двойную связь (хромофорные группы) или ароматические циклы, например, дибензфенон или флуоресцин
 дибензфенон
дибензфенон  флуоресцин
флуоресцин
Механизм действия фотосенсибилизаторов (Ф) следующий:


 Ф + hn Ф* Ф* + М Ф + М* М* М · + М ·
Ф + hn Ф* Ф* + М Ф + М* М* М · + М ·
Таблица 11 - Основные группы инициаторов радикальной полимеризации, механизм и условия их распада
| Органорастворимые | Условия распада | Водорастворимые | Условия распада |
1. Пероксид бензоила (ПБ)
 2. Пероксид дитретбутила
2. Пероксид дитретбутила
 3.Гидропероксид изопропилбензола
(кумола) - ГИПЕРИЗ
3.Гидропероксид изопропилбензола
(кумола) - ГИПЕРИЗ
 4. Динитрилазобисизомасляной кислоты -ДИНИЗ
4. Динитрилазобисизомасляной кислоты -ДИНИЗ
 5. Диазоаминобензол
5. Диазоаминобензол

| Тр=850С Еа =113 кДж/моль Тр=1300С Еа =150 кДж/моль Тр=1600С Еа =130 кДж/моль Тр= 600С Еа =112 кДж/моль Тр= 600С | Персульфат аммония (К, Nа)
 Пероксид водорода
Пероксид водорода
 Окислительно-восстановительные системы
Окислительно-восстановительные системы



| Тр= 50-700С Тр= 500С Трмогут быть меньше00С |
Термическое инициирование – это вариант образования радикалов роста из молекул мономера, который проявляется при нагревании до температуры Т=1000С и выше. Однако этот вид инициирования изучен только для полимеризации метилметакрилата и стирола. Энергия активации термического инициирования Еаи (Т) = 146 кДж/моль. Термическое инициирование протекает специфично, через стадию образования бирадикала мономера:

Бирадикалы рекомбинируют и далее протекает рост цепи в обе стороны.
Радиационное инициирование протекает под действием энергии квантов частиц высоких энергий:a,b,g-лучей, потока ускоренных электронов (ПУЭ), потока нейтронов и др. Это инициирование идет в три стадии:
 А) частицами выбивается электрон из молекул мономера М + hnрад М+ + `е
А) частицами выбивается электрон из молекул мономера М + hnрад М+ + `е
 Б) катион мономера распадается на радикал и меньший радикал М+ R1· + R2+
Б) катион мономера распадается на радикал и меньший радикал М+ R1· + R2+
В) катион R2+ присоединяет выбитый электрон и превращается в радикал R2·:
 R2++`е R2·
R2++`е R2·
У фотохимического, термического и радиационного инициирования есть ряд недостатков, вызванных протекающими побочными процессами:
· Образование разветвленных макромолекул
· Сшивание макромолекул
· Деструкция макромолекул
· Трудность регулирования процесса, особенно при термическом инициировании
Вследствие этого данные виды инициирования применяются реже, чем чисто химическое и окислительно-восстановительное инициирование.
Поиск по сайту: