 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Изохорный процесс
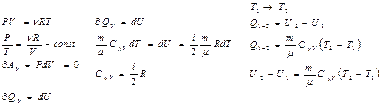
Обмен энергией между закрытой термодинамической системой и внешними телами может осуществляться двумя качественно различными способами: путём совершения работы и путём теплообмена. Энергия, передаваемая при этом рассматриваемой термодинамической системе внешними телами, называется работой, совершаемой над системой.
Энергия, передаваемая системе внешними телами путём теплообмена, называется теплотой получаемой системой от внешней среды.
В отсутствии внешних силовых полей обмен энергией между неподвижной системой и внешней средой может осуществляться путём совершения работы лишь в процессе изменения объёма и формы системы. При этом работа, совершаемая внешними телами над системой, численно равна и противоположна по знаку работе совершаемой самой системой над внешней средой.
Полная работа при изменении объёма газа А=v1∫v2PdV.
Понятие теплоты и работы имеют смысл только в связи с процессом изменения системы.
17. Первое начало термодинамики. Теплоёмкость.
Первое начало термодинамики устанавливает внутренняя энергия системы является однозначная функция ее состояния и изменяется только под влиянием внешних воздействий.
В термодинамике рассматриваются два типа внешних взаимодействий: воздействие, связанное с изменением внешних параметров системы, и воздействие не связанные с изменением внешних параметров и обусловленные изменением внутренних параметров или температуры.
Поэтому, согласно первому началу, изменение внутренней энергии U2-U1 системы при ее переходе под влиянием этих воздействий из первого состояния во второе равно алгебраической сумме Q и W, что для конечного процесса запишется в виде уравнения U2 - U1 = Q - W или Q = U2 - U1 + W (1.1)
Первое начало формируется как постулат и является обобщением большого количества опытных данных
Для элементарного процесса уравнение первого начала такого: dQ = dU + dW (1.2)
dQ и dW не являются полным дифференциалом, так как зависят от пути следования.
Зависимость Q и W от пути видна на простейшем примере расширение газа. Работа совершенная системой при переходе ее из состояния 1 в 2 (рис. 1) по пути а изображается площадью, ограниченной контуром А1а2ВА: Wа = p(V,T) dV;
а работа при переходе по пути в - площадью ограниченную контуром А1в2ВА: Wb = p(V,T) dV.

Рис. 1
Первое начало можно сформулировать в нескольких видах:
1. Невозможно возникновение и уничтожение энергии.
2. Любая форма движения способна и должна превращаться в любую другую форму движения.
3. Внутренняя энергия является однозначной формой состояния.
4. Вечный двигатель первого рода невозможен.
5. Бесконечно малое изменение внутренней энергии является полным дифференциалом.
6. Сумма количества теплоты и работы не зависит от пути процесса.
Удельная теплоемкость вещества — величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К: 
Единила удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг•К)).
Молярная теплоемкость —величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:  (1)
(1)
где ν =m/М—количество вещества.
Единица молярной теплоемкости — джоуль на моль•кельвин (Дж/(моль•К)).
Удельная теплоемкость с связана с молярной теплоемкостью Сm, соотношением  (2)
(2)
где М — молярная масса вещества.
Выделяют теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
18. Адиабатный процесс. Уравнение Пауссона.
Адиабатный процесс — процесс, при котором отсутствует теплообмен между системой и окружающей средой.
Из первого начала термодинамики следует, что работа газа при адиабатном процессе совершается за счет его внутренней энергии:
 (1).
(1).
С другой стороны, из уравнения Клапейрона-Менделеева следует:  (2).
(2).
Разделим уравнение (2) на уравнение (1):
 , где
, где
 .
.
Проинтегрируем полученное уравнение:  .
.
Таким образом, при адиабатном процессе
 или
или  — уравнение Пуассона.
— уравнение Пуассона.
С учетом уравнения Клапейрона-Менделеева ( ,
,  )
)
уравнение Пуассона может быть представлено в виде:  или
или 
 или
или 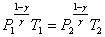 .
.

График адиабатного процесса — более крутая кривая, чем гипербола при изотермическом процессе. Это следует из выражения производной  , полученной из уравнения Пуассона.
, полученной из уравнения Пуассона.
Работа газа при адиабатном процессе равна убыли внутренней энергии:
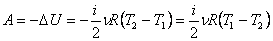 .
.
19. Циклы. Тепловые машины. КПД.
Цикл Карно является обратимым циклическим процессом с двумя источниками теплоты, имеющими разные, но постоянные температуры. Так как температуры источников тепла постоянные, а процессы получения и отдачи рабочим веществом тепла должны быть обратимыми, то эти процессы могут быть только изотермическими. При этом температура рабочего вещества в цикле должна, очевидно, меняться без теплообмена с окружающей средой, т.е. в адиабатных условиях. Поэтому цикл Карно состоит из двух обратимых изотермических и двух обратимых адиабатных процессов, чередующихся между собой.
Цикл Карно осуществляется рабочим веществом следующим образом (рис. 1).

|
| рис. 1 |
Рабочее вещество, расширяясь изотермически от состояния  до состояния
до состояния  , получает количество тепла
, получает количество тепла  от горячего источника, имеющего температуру на бесконечно малую величину
от горячего источника, имеющего температуру на бесконечно малую величину  большую, чем температура рабочего вещества (обратимость), т. е.
большую, чем температура рабочего вещества (обратимость), т. е.  . При этом, если в качестве рабочего вещества взять идеальный газ, то он производит работу (2.7.22), равную количеству полученного тепла
. При этом, если в качестве рабочего вещества взять идеальный газ, то он производит работу (2.7.22), равную количеству полученного тепла  :
:

| (4.11.1) |
В состоянии 2 к рабочему веществу прекращается подвод тепла и затем в обратимом адиабатном процессе расширения до объема  температура рабочего вещества уменьшается до температуры T2, которая на бесконечно малую величину dT больше температуры холодного источника
температура рабочего вещества уменьшается до температуры T2, которая на бесконечно малую величину dT больше температуры холодного источника  Далее рабочее вещество изотермически
Далее рабочее вещество изотермически  обратимо сжимается от объема V3 до объема V4. При этом рабочее вещество (идеальный газ) отдает холодному источнику количество тепла
обратимо сжимается от объема V3 до объема V4. При этом рабочее вещество (идеальный газ) отдает холодному источнику количество тепла

| (4.11.2) |
Откуда находим 
| (4.11.3) |
Наконец, замыкающим цикл процессом является обратимый адиабатный процесс, в котором рабочее вещество возвращается в начальное состояние 1.
Вычислим КПД цикла Карно. По определению КПД любого цикла

| (4.11.4) |
Подставляя выражения (4.11.1) и (4.11.3) в (4.11.4), получим

| (4.11.5) |
Из последнего выражения видно, что КПД цикла не зависит от количества рабочего вещества  . Уравнение адиабаты идеального газа
. Уравнение адиабаты идеального газа  запишем для двух адиабатных процессов 23 и 41:
запишем для двух адиабатных процессов 23 и 41:

| (4.11.6) |
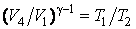
| (4.11.7) |
Откуда находим 
| (4.11.8) |
Подставив последнее выражение в (4.11.5), будем иметь: 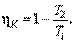
| (4.11.9) |
Таким образом, КПД цикла Карно, произведенного с идеальным газом, определяется только температурами T1 (горячего) и T2 (холодного) источников тепла. При этом  тем больше, чем больше разность между T1 и T2. КПД цикла Карно равен 1 в двух практически недостижимых случаях: когда
тем больше, чем больше разность между T1 и T2. КПД цикла Карно равен 1 в двух практически недостижимых случаях: когда  или, когда T2 =0. Если КПД цикла равен единице, то из выражения (4.11.4) следует, что Q2=0, т. е. все тепло Q1, полученное от горячего источника, преобразуется в работу, что запрещено вторым началом термодинамики. Следовательно, КПД никакого цикла, в том числе и цикла Карно, не может быть равен единице.
или, когда T2 =0. Если КПД цикла равен единице, то из выражения (4.11.4) следует, что Q2=0, т. е. все тепло Q1, полученное от горячего источника, преобразуется в работу, что запрещено вторым началом термодинамики. Следовательно, КПД никакого цикла, в том числе и цикла Карно, не может быть равен единице.
Поиск по сайту: