 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ХІV.3 Виникнення стрибка потенціалу та будова подвійного електричного шару на межі розчин – метал
Існує декілька теорій, що пояснюють виникнення стрибка потенціалу на межі розчин – метал. Найбільш сучасною є сольватаційна теорія.
З металу, у вузлах кристалічної решітки якого знаходяться позитивно заряджені іони, опущеного в розчин електроліту, частина іонів переходить у цей розчин. Цьому процесу сприяє взаємодія іонів з молекулами розчинника з подальшою його повною сольватацією. Одночасно відбувається і зворотний процес, тобто руйнування сольватної оболонки іонів, що знаходяться в розчині, і їх включення в кристалічну решітку металу. Якщо в момент занурення швидкість процесу переходу іонів у розчин v1 більша швидкості зворотного переходу іонів з розчину в метал v2, то на поверхні металу з’являється надлишковий негативний заряд (надлишкові електрони). Розчин набуває позитивного заряду. Позитивно заряджені іони не відходять від поверхні металу, а внаслідок електростатичних взаємодій накопичуються біля поверхні. Внаслідок таких процесів утворюється так званий подвійний електричний шар (п.е.ш.), який можна уявити собі у вигляді конденсатора, негативна обкладинка якого утворена металом, а позитивна – шаром катіонів у розчині, що дотикається до металу. Між різнойменно зарядженими обкладинками виникає стрибок потенціалу. Якщо в момент занурення металу в розчин швидкість переходу іонів у розчин v1 менша швидкості переходу іонів з розчину на метал v2, то поверхня металу зарядиться позитивно, і негативно заряджені іони притягнуться до поверхні металу, створюючи надлишок негативних зарядів. Таким чином, напрямок переходу іонів залежить від співвідношення роботи виходу іонів з кристалічної решітки Wм і роботи виходу іонів з розчину Wр.
Якщо в момент занурення електрод зарядиться негативно (v1>v2), то в наступний момент відривання іонів з металу вимагатиме подолання більшого електричного бар’єру. Кожний наступний катіон, що переходить у розчин, долає все більш високий енергетичний бар’єр у зв’язку зі зростанням негативного заряду металічної пластинки, що перешкоджає переходу іонів металу в розчин. Робота виходу іонів з металу Wм відповідно буде зростати. При цьому буде зменшуватись швидкість переходу іонів з металу в розчин v1. Швидкість v2, навпаки, буде зростати в міру збільшення негативного заряду металу, що зменшує енергетичний бар’єр переходу іонів з розчину в метал, тобто зменшуватиметься робота виходу іонів з розчину Wp.
Таким чином, в міру збільшення негативного заряду буде зменшуватись різниця електрохімічних потенціалів  і різниця швидкостей v1 – v2. Зміна електрохімічних потенціалів буде супроводжуватись зміною стрибка потенціалу на межі розчин – метал. Кінцевим наслідком буде те, що величини електрохімічних потенціалів
і різниця швидкостей v1 – v2. Зміна електрохімічних потенціалів буде супроводжуватись зміною стрибка потенціалу на межі розчин – метал. Кінцевим наслідком буде те, що величини електрохімічних потенціалів 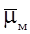 і
і  стануть однаковими:
стануть однаковими: 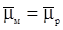 . При цьому стануть однаковими швидкості: v1 = v2, і встановиться динамічна рівновага.
. При цьому стануть однаковими швидкості: v1 = v2, і встановиться динамічна рівновага.
Таким чином, подвійний електричний шар створюється електричними зарядами, що знаходяться на металі, і іонами протилежного заряду (проти іонами), які орієнтовані в розчині біля поверхні електрода (рис. 77).
У формуванні іонної обкладинки п.е.ш. беруть участь як електростатичні сили, під впливом яких протиіони підходять до поверхні електроду, так і сили теплового (молекулярного) руху, внаслідок дії яких п.е.ш. набуває розмитої дифузної будови. Окрім цього, в створенні п.е.ш. на межі розчин – метал суттєву роль відіграє ефект специфічної адсорбції поверхнево – активних іонів і молекул, які можуть міститись в електроліті.
Спрощено іонну обкладинку можна умовно розділити на дві частини (рис. 77): 1) щільну або гельмгольцівську, що утворена іонами, які впритул підійшли до металу;
 |
2) дифузну, що створена іонами, які знаходяться на певних віддалях від металу і перевищують радіус сольватованого іона (рис. 77, І). Товщина щільної частини порядку 10-8см, дифузійної – 10-7 – 10-3см.
Розподіл потенціалу в іонній обкладинці п.е.ш., що ілюструє його будову, подано на рис. 77, ІІ. Величина стрибка потенціалу ε на межі розчин – метал відповідає сумі величин падіння потенціалу ψ в щільній частині п.е.ш. і ψ1 – в дифузній. Будова п.е.ш. визначається загальною концентрацією розчину. Зі зростанням концентрації дифузія протиіонів від поверхні металу в масу розчину послаблюється, внаслідок чого зменшуються розміри дифузної частини. Це веде до зміни ψ1 – потенціалу. В концентрованих розчинах дифузна частина практично відсутня, і п.е.ш. подібний до плоского конденсатора, що відповідає моделі Гельмгольца, яка була запропонована в 1853 р.
Як відмічалося вище, важливу роль у будові подвійного електричного шару відіграє специфічна адсорбція. Адсорбція відбувається за рахунок електростатичних сил, сил міжмолекулярної взаємодії і хімічної взаємодії. Адсорбцію, викликану силами неелектростатичної взаємодії, прийнято називати специфічною. Речовини, що здатні адсорбуватись на межі розділу фаз, називаються поверхнево – активними (ПАР). До них відносяться більшість аніонів, деякі катіони і багато молекулярних сполук. Специфічна адсорбція ПАР, що містяться в електроліті, впливає на структуру подвійного шару і величину ψ1 – потенціалу (рис. 78). Крива 1 відповідає розподілу потенціалу в п.е.ш., коли відсутні в розчині ПАР. Якщо розчин містить речовини, що утворюють при дисоціації поверхнево активні катіони, то за рахунок специфічної адсорбції поверхнею металу катіони будуть входити в щільну частину подвійного шару, збільшуючи його позитивний заряд (крива 2). В умовах, що сприяють підсиленню адсорбції, в щільній частині може виявитись надлишкова кількість позитивних зарядів порівняно з негативним
 зарядом металу (крива 3). За кривими розподілення потенціалу в подвійному шарі видно, що ψ1 – потенціал змінюється при адсорбції катіонів і може мати знак, протилежний до знака потенціалу, коли відсутня специфічна адсорбція.
зарядом металу (крива 3). За кривими розподілення потенціалу в подвійному шарі видно, що ψ1 – потенціал змінюється при адсорбції катіонів і може мати знак, протилежний до знака потенціалу, коли відсутня специфічна адсорбція.
Ефект специфічності адсорбції спостерігається і на незарядженій частині поверхні металу, тобто при таких умовах, коли обмін іонами між металом і розчином відсутній. Адсорбовані іони і відповідні протиіони утворюють п.е.ш., що розташований безпосередньо близько до металу зі сторони розчину. Орієнтовані біля поверхні металу адсорбовані полярні молекули (ПАР, розчинника) також створюють п.е.ш. Стрибок потенціалу, що відповідає подвійному електричному шару при незарядженій поверхні металу, називається потенціалом нульового заряду (п.н.з.).
Потенціал нульового заряду визначається природою металу і складом електроліта. При адсорбції катіонів п.н.з. стає більш позитивним. Потенціал нульового заряду є важливою електрохімічною характеристикою електродів.
При потенціалах, що близькі до п.н.з., деякі властивості металів досягають граничних значень: велика адсорбція ПАР, максимальна твердість, мінімальна змочуваність розчинами електролітів і інші.
Процеси, що протікають на електродах, можна записати у вигляді таких рівнянь:
перехід іонів металу в розчин (анодний процес):
М → Мz+ + z ē;
перехід іонів в метал (катодний процес):
Мz+ + z ē → М;
а в загальному вигляді:
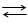 Оx + z ē‘ Red.
Оx + z ē‘ Red.
Максимальна корисна робота Wмакс (і рівне їй зменшення ізобарного потенціалу ΔG цієї реакції в розрахунку на 1 моль-іонів М+) рівна роботі електричного струму zFε, тобто:
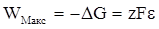 (XIV.3.1).
(XIV.3.1).
Керуючись положеннями хімічної рівноваги для такої реакції, можна записати
 (XIV.3.2)
(XIV.3.2)
Співставляючи рівняння (XIV.3.1) і (XIV.3.2), отримаємо
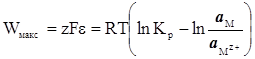 (XIV.3.3)
(XIV.3.3)
або
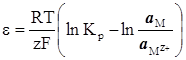 (XIV.3.4)
(XIV.3.4)
Враховуючи, що а м = 1, рівняння (XIV.3.4) запишемо
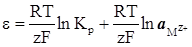 (XIV.3.5)
(XIV.3.5)
При сталій температурі перший член правої частини рівняння (XIV.3.5) містить лише сталі величини, а значить, також є сталою величиною. Позначимо цю сталу величину символом εº. Тоді
 (XIV.3.6)
(XIV.3.6)
Якщо активність потенціал-визначаючих іонів рівна одиниці: а м+ = 1, то другий член правої частини цього рівняння перетвориться в нуль. В цьому випадку ε = ε˚. Таким чином, ε˚ - електродний потенціал, який виникає при зануренні металу в розчин, в якому активність іонів металу рівна 1 моль/л. Ця величина одержала назву стандартного електродного потенціалу. Рівняння було (в 1890 р.) вперше виведене В. Нернстом.
У розбавлених розчинах замість активності можна підставляти концентрації і рівняння прийме вигляд:
 . (XIV.3.7)
. (XIV.3.7)
Поиск по сайту: