 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Горючее – сложное вещество с известным элементным составом
В этом случае теоретический выход продуктов горения определяется как сумма продуктов горения каждого элемента, входящего в состав вещества.
Рассчитаем, какой теоретический объем продуктов горения образуется при сгорании 1 кг каждого элемента при нормальных условиях.
Для углерода:
1 кг х1 м3 х2 м3
С + (О2 + 3,76N2) = СО2 + 3,76N2
12 кг 22,4 м3 3,76×22,4 м3
V(СО2) = х1 = 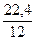 = 1,87 м3
= 1,87 м3
V(N2) = х2 =  = 7,0 м3
= 7,0 м3
Для водорода:
1 кг х1 м3 х2 м3
Н + 0,25(О2 + 3,76N2) = 0,5Н2О + 0,25×3,76N2
1 кг 0,5×22,4 м3 0,25×3,76×22,4 м3
V(Н2О) = х1 =  = 11,2 м3
= 11,2 м3
V(N2) = х2 =  = 21,0 м3
= 21,0 м3
Для серы:
1 кг х1 м3 х2 м3
S + (О2 + 3,76N2) = SО2 + 3,76N2
32 кг 22,4 м3 3,76×22,4 м3
V(SО2) = х1 =  = 0,7 м3
= 0,7 м3
V(N2) = х2 = 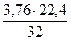 = 2,63 м3
= 2,63 м3
Для фосфора:
1 кг х1 м3 х2 м3
Р + 1,25(О2 + 3,76N2) = 0,5Р2О5 + 1,25×3,76N2
31 кг 0,5×22,4 м3 1,25×3,76×22,4 м3
V(Р2О5) = х1 =  = 0,36 м3
= 0,36 м3
V(N2) = х2 =  = 3,4 м3
= 3,4 м3
В состав горючего вещества может входить азот, влага, которые удаляются вместе с продуктами горения.
Объем 1 кг азота при нормальных условиях составит:
V(N2) =  = 0,8 м3
= 0,8 м3
При нормальных условиях 1 кг паров воды займет объем:
V(Н2О) =  = 1,24 м3
= 1,24 м3
Если в состав горючего вещества входит кислород, то при горении он будет расходоваться на окисление горючих компонентов (углерода, водорода, серы, фосфора) и, поэтому из воздуха на горение будет израсходовано кислорода меньше на количество, которое содержалось в горючем веществе. Следовательно, в продуктах горения и азота будет меньше на количество, которое приходилось бы на кислород, если бы он находился не в горючем веществе, а в воздухе.
На 1 кг кислорода в воздухе будет приходиться объем азота, равный
V(N2) = 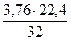 = 2,63 м3
= 2,63 м3
Полученные значения выходов продуктов горения элементов приведены в таблице 2.1.
Таблица 2.1.Теоретический объем продуктов горения элементов сложных веществ при нормальных условиях
| Элемент | Объем продуктов горения (м3) на 1 кг вещества | ||||
| СО2 | Н2О | SO2 | Р2О5 | N2 | |
| Углерод | 1,87 | 7,0 | |||
| Водород | 11,2 | 21,0 | |||
| Сера | 0,7 | 2,63 | |||
| Фосфор | 0,36 | 3,4 | |||
| Азот в горючем | 0,8 | ||||
| Азот за счет кислорода в горючем | - 2,63 | ||||
| Влага в горючем | 1,24 |
Используя данные таблицы 3.1., можно вычислить объем продуктов горения любого вещества с известным элементным составом.
Пусть w (С), w (Н), w (S), w (О),w (N) – – массовые доли элементов в веществе, %; w (W) – содержание влаги в веществе, %.
Тогда общие формулы для расчета каждого компонента продуктов горения при сгорании заданной массы (m) вещества будут иметь следующий вид:
V(СО2) = m×  , м3 (2.9)
, м3 (2.9)
V(H2O) = m×  , м3 (2.10)
, м3 (2.10)
V(SО2) = m×  , м3 (2.11)
, м3 (2.11)
V(N2) = m×  , м3 (2.12)
, м3 (2.12)
| Расчет объема и процентного состава продуктов горения вещества сложного элементного состава | Пример 2.10. Определить объем и процентный состав продуктов горения 5 кг каменного угля следующего состава (в %): С – 75,8 %, Н – 3,8 %, О – 2,8 %, S – 2,5 %, N – 1,1 %, W – 3,0 %, зола – 11,0 %. Горение протекает при a = 1,3, условия нормальные. |
1. По формулам (2.9) – (2.12) определяем объем каждого компонента продуктов горения 5 кг каменного угля.
V(СО2) = 5 ×  = 7 м3
= 7 м3
V(H2O) = 5 ×  = 2,31 м3
= 2,31 м3
V(SО2) =5 × 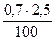 = 0,085 м3
= 0,085 м3
V(N2) = 5 ×  = 33,14 м3
= 33,14 м3
VПГ = 7 + 2,31 + 0,085 + 33,14 = 42,5 м3
2. Горение протекает с коэффициентом избытка воздуха 1,3, следовательно, в состав продуктов горения будет входить избыточный воздух.
По формуле (2.8) определяем теоретический объем воздуха, необходимый для горения данной массы образца угля:
Vвтеор = 5 ×  = 38,6 м3
= 38,6 м3
Избыток воздуха определим по формуле (2.4):
DVв= Vвтеор(a -1) = 38,6×(1,3 – 1) = 11,6 м3
С учетом избытка воздуха практический объем продуктов горения составит:
VПГ* = VПГ + DVв = 42,5 + 11,6 = 54,1 м3
3. Определим процентный состав продуктов горения:
jоб (СО2) =  =
=  = 12,9 %
= 12,9 %
jоб (Н2О) =  =
= 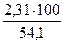 = 4,3 %
= 4,3 %
jоб (SО2) =  =
=  = 0,2 %
= 0,2 %
jоб (N2) = 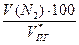 =
=  = 61,2 %
= 61,2 %
jоб (DVв) =  =
=  = 21,4 %
= 21,4 %
Поиск по сайту: