 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Этиленовые углеводороды
|
Читайте также: |
 СnН2n
СnН2n
| Тип строения |  σ
―С = С―
| π |
второе валентное
состояние
sр2-гибридизация
СН2=СН2
этилен σ
―С = С―
| π |
второе валентное
состояние
sр2-гибридизация
СН2=СН2
этилен
| ||||||||
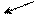 в молекулах алкенов есть в молекулах алкенов есть
 связи: σ, π связи: σ, π
| ℓ = 134 н.м ℓ = 108 н.м. Е = 617 кДж/моль Е = 435 кДж/моль | |||||||||
| Способы получения | 1. Дегидрирование алканов (крекинг термический, каталитический).
Т; кат; Р
 Сn Н2 n+2 Сn Н2 n
-Н2
2. Дегидратация спиртов (водоотнимающие средства: Н2SО4, Н3РО4, ZnСl2, Аl2О3). Сn Н2 n+2 Сn Н2 n
-Н2
2. Дегидратация спиртов (водоотнимающие средства: Н2SО4, Н3РО4, ZnСl2, Аl2О3).
  Н ОН R R/// Н ОН R R///
   | | С = С
R―С―С―R/// - Н2О R/ R//
| |
R/ R//
3. Дегидрогалогенирование алкилгалогенидов (дегидрогалогенирующие средства: твердые NаОН и КОН; спиртовые растворы щелочей).
Н Н | | С = С
R―С―С―R/// - Н2О R/ R//
| |
R/ R//
3. Дегидрогалогенирование алкилгалогенидов (дегидрогалогенирующие средства: твердые NаОН и КОН; спиртовые растворы щелочей).
Н Н
 | | КОН
R―С―С―R/ (спирт) R―СН = СН ― R/ + КХ + Н2
| |
Х Н
4. Дегалогенирование дигалогеналкилов.
Х Х | | КОН
R―С―С―R/ (спирт) R―СН = СН ― R/ + КХ + Н2
| |
Х Н
4. Дегалогенирование дигалогеналкилов.
Х Х
 | | Zn
R―С―С―R/ -ZnХ2 R―СН = СН ― R/
| |
Н Н
5. Восстановление алкинов (применяются отравленные катализаторы).
Н2/кат. | | Zn
R―С―С―R/ -ZnХ2 R―СН = СН ― R/
| |
Н Н
5. Восстановление алкинов (применяются отравленные катализаторы).
Н2/кат.
 R―С ≡ С―R/ R―СН = СН ― R/ R―С ≡ С―R/ R―СН = СН ― R/
| ||||||||
| Характеристика химической активности | Активные соединения. Причина активности – наличие непрочной, легко деформируемой π-связи. | ||||||||
| Реакции замещения | Не характерны. | ||||||||
| Реакции присоединения | Наиболее характерны. | ||||||||
| |
 −С = С− + Н2 → ―С―С― реакция гидрирования
| |
Н Н −С = С− + Н2 → ―С―С― реакция гидрирования
| |
Н Н
| |||||||||
  | | | |
―С―С― + Г2 (Сl2, Вr2) → ―С―С― реакция
| | | | галогенирования
Вr Вr (хлорирования,
бромирования). | | | |
―С―С― + Г2 (Сl2, Вr2) → ―С―С― реакция
| | | | галогенирования
Вr Вr (хлорирования,
бромирования).
| |||||||||
| | | | | ―С=С― + НОН → ―С―С― реакция гидратации | | Н ОН | |||||||||
  | | | |
―С―С― | | | |
―С―С―   + НГ → ―С―С― реакция
| | (НСl, НВr) | | гидрогалогенирования
Н Г (гидрохлорирования,
гидробромирования) + НГ → ―С―С― реакция
| | (НСl, НВr) | | гидрогалогенирования
Н Г (гидрохлорирования,
гидробромирования)
| |||||||||
  | | | |
―С―С― + НО-SО3Н → ―С―С―
| | | |
Н ОSО3Н | | | |
―С―С― + НО-SО3Н → ―С―С―
| | | |
Н ОSО3Н
| |||||||||
| Примечание: присоединение полярных молекул протекает по правилу Марковникова: при присоединении полярных молекул к несимметричным алкенам, водород из реагента присоединяется по месту разрыва непрочной π- связи к более гидрированному атому углерода. | |||||||||
| Реакции отщепления | Не характерны | ||||||||
| Реакции окисления | 1. Окисление слабыми окислителями. Реакция Вагнера. | ||||||||
| | КМnО4, t0 | |
 ―С = С― + О + НОН ―С―С― гликоли
щелочной | | (двухатомные
или водный р-р ОН Н спирты) ―С = С― + О + НОН ―С―С― гликоли
щелочной | | (двухатомные
или водный р-р ОН Н спирты)
| |||||||||
| 2. Окисление сильными окислителями. | |||||||||
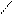   | | КМnО4, t0 О О | | КМnО4, t0 О О
    R―С = С―R′ + [О] Н2SО4 R―С + R′―С R―С = С―R′ + [О] Н2SО4 R―С + R′―С
 ОН ОН
карбоновые кислоты ОН ОН
карбоновые кислоты
| |||||||||
3. Озонирование
 
| |||||||||
    | | | О | Н2О | | | О | Н2О
   ―С = С― + О3 → ―С С― С = О + С =О +Н2О2 ―С = С― + О3 → ―С С― С = О + С =О +Н2О2
  альдегиды, кетоны
О―О
неустойчивый азонид альдегиды, кетоны
О―О
неустойчивый азонид
| |||||||||
| Реакции полимеризации | Идут по радикальному, ионному механизму. Приводят к образованию полимеров – высокомолекулярных соединений. | ||||||||
 
 СН2=СН + СН2=СН +…→ ―СН2―СН―СН2―СН―…→
| | | |
R R R R СН2=СН + СН2=СН +…→ ―СН2―СН―СН2―СН―…→
| | | |
R R R R
| |||||||||
| → (―СН2―СН―)n | R |
Алкины
Поиск по сайту:


