 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
БІЛКИ. ЇХНЯ БУДОВА
Згадаєте! Що таке макромолекули? Що являють собою мономери й полімери?
Серед макромолекул за функціональним значенням і кількісним відношенням провідна роль у клітині належить білкам. У клітинах животных вони становлять 40-50%, а рослин -20-35% їхньої сухої маси. Білки містять 51-55% вуглецю, 21-23% - кисню, 15-18% - азоту, 6,6-7,3%) - водню, 0,3-2,4% - сірки. До складу білків можуть входити фосфор, залізо й деякі інші хімічні елементи.
Білки - це високомолекулярні полімери, мономерами яких є залишки амінокислот. В організмі людини
зустрічається понад 5 млн типи білкових молекул. Ця розмаїтість забезпечується комбінацією залишків тільки 20 амінокислот (кількість можливих варіантів у цьому випадку - приблизно 2 • 1018). Кожний конкретний білок характеризується постійним складом амінокислотних залишків і їхньою певною послідовністю.
Всі амінокислоти мають загальну групу атомів. Вона складається з аминогруппы (-NH2), для якої характерні лужні властивості, і карбоксильной групи (-СООН) з кислотними властивостями. Ці групи також, як і атом водню, пов'язані з тим самим атомом вуглецю. Амінокислоти відрізняються одна від іншої бічними ланцюгами (їх називають радикала мі, або R-группа-ми), які в різних амінокислот неоднакові за хімічною структурою, електричному заряду, розчинності у воді й ін. ознакам. Загальна формула амінокислот має вигляд:

■■ Двадцять амінокислот, залишки яких входять до складу білків, названі основними, щоб відрізнити їх від інших, присутніх в організмах, але не вхідних до складу білків. Основні амінокислоти для скороченого запису позначають трьома буквами (див. таблицю).
Розроблено класифікацію амінокислот, в основу якої покладена можливість їхнього синтезу в організмі людини - замінні й незамінні. Перші з них утворяться в організмі людини, а другі - попадають у нього тільки з харчовими продуктами. Їх синтезують рослини, гриби, бактерії.
Будова білків Як ми вже відзначали, особливістю амінокислот є одночасна наявність карбоксильных і аминогрупп, що має відповідно кислотні й лужні властивості. Тому амінокислоти - амфотерні з'єднання (тобто об'єднуючі властивості кислот і лугів). Цим обумовлена здатність амінокислот до взаємодії.
Скорочені позначення амінокислот
(не для запам'ятовування)


Амінокислотні залишки з'єднуються ковалентної (пептидной) зв'язком, що виникає між карбоксильной групою однієї амінокислоти й аминогруппой іншої (- З - NH -). При об'єднанні двох амінокислот виникає дипептид і виділяється молекула води. Амінокислотні залишки, зв'язані пептидными зв'язками, утворять поліпептид:

Молекула білка може складатися з однієї або декількох поліпептидних ланцюгів, що містять від декількох до багатьох тисяч амінокислотних залишків.
Функціональні властивості білків залежать не тільки від складу амінокислотних залишків, але також від послідовності їхнім розташуванням поліпептидного ланцюга, від її просторової структури (конфігурації).
Розрізняють чотири рівні структурної організації білків: первинний, вторинний, третинний і четвертинний.
Первинна структура визначається якісним і кількісним складом амінокислотних залишків, а також їхньою послідовністю. В основі утворення первинної структури лежать пептидные зв'язку.
На малюнку 5 наведена первинна структура білка інсуліну, що складає із двох поліпептидних ланцюгів. За допомогою різноманітних фізико-хімічних методів дослідження розшифрована первинна структура багатьох білків.
Вторинна структура характеризує просторову організацію білкової молекули, що повністю або частич-
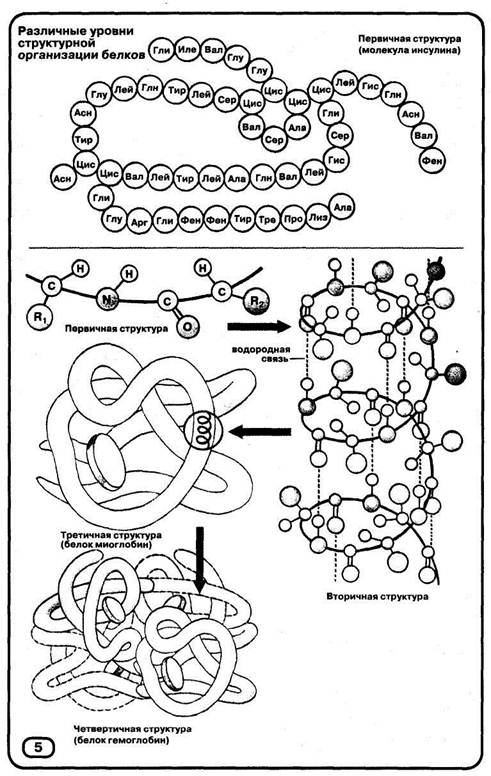
але закручується в спіраль. Радикали амінокислот (R-групи) залишаються при цьому поза спіраллю. У стабілізації вторинної структури важливу роль грають водневі зв'язки, що виникають між спрямованими уздовж спіралі атомами водню NH2-rpyn-пы одного завитка спіралі й кисню Група^-групи-з-групи іншого.
Третинна структура відображає здатність поліпептидної спіралі укладатися, закручуючись певним чином. На малюнку 5 схематично зображена структура білка миоглоби-на. Формування третинної структури обумовлено різними типами нековалентних взаємодій (гідрофобних, іонних і водневих зв'язків), що приводять до виникнення конфігурації за назвою глобула (від лат. глобулюс - кулька). Важлива роль у стабілізації третинної структури належить дисульфидным зв'язкам, що виникають між залишками амінокислоти цистеина.
Четвертинна структура білків виникає внаслідок об'єднання окремих глобул, які в сукупності утворять функціональну одиницю. На малюнку 5 схематично представлена четвертинна структура гемоглобіну, молекула якого складається із чотирьох фрагментів білка міоглобіну. Стабілізація четвертинної структури визначається гідрофобними, електростатичними й іншими взаємодіями, водневими зв'язками.
Гкок.-'.ти я (>!'лкчш. Під впливом різних факторів (дія концентрованих кислот і лугів, важких металів, високої температури й ін.) структура й властивості білків можуть змінюватися. Процес порушення природної структури білків, що супроводжується розгортанням поліпептидного ланцюга без порушення пептидных зв'язків, називається денатурацією (від лат. де - приставка, що означає втрату, і натура - природні властивості). Як правило, денатурація має необоротний характер. Але на перших стадіях денатурації, за умови припинення дії негативних факторів, білок може відновити свій первісний стан (явище ренатурации; від лат. ре -приставка, що означає поновлення, і натура). В організмів звичайно спостерігається часткова оборотна денатурація білків, що відбуває при виконанні ними своїх функцій (рухової, передачі сигналів, каталізі біохімічних реакцій і ін.).
Процес руйнування первинної структури білків, називаний деструкцією (від лат. де й струкцио - руйнування), завжди необоротний.
Залежно від розчинності у воді розрізняють білки гідрофільні й гідрофобні.
По будові білки діляться на прості - протеїни (від греч. протос — перший), що складаються тільки з амінокислотних залишків, і складні - протеїди (від греч. протос і ейдос - вид), до складу яких входять і інші з'єднання - залишки фосфорної й нуклеиновых кислот, вуглеводів, ліпідів.

,. КОНТРОЛЬНІ ПИТАННЯ:
1. Що таке білки? Яке вони мають будову? 2. Що таке замінної й незамінної амінокислоти? 3. Яким образом амінокислоти з'єднуються в поліпептидний ланцюг? 4. Які існують рівні структурної організації білків? 5. Які властивості білків ви знаєте?
Подумайте! Що загальне мають і чим відрізняються процеси денатурації й деструкції? Чим обумовлена розмаїтість властивостей білків?
Поиск по сайту: