 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Правило фаз, построение диаграмм состояния
Процесс кристаллизации металлических сплавов и связанные с ним многие закономерности строения сплавов описывают с помощью диаграмм фазового равновесия, которые в удобной графической форме показывают фазовый состав и структуру в зависимости от температуры и концентрации. Диаграммы построены для условий равновесия; равновесное состояние соответствует минимальному значению свободной энергии.
Рассмотрение диаграмм состояния позволяет определить фазовые превращения в условиях очень медленного охлаждения или нагрева. Закономерность изменения числа фаз в гетерогенной системе определяется правилом фаз.
Фаза – однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела, при переходе через которую химический состав или структура вещества изменяется скачкообразно.
При изучении физико-химических равновесий за внешние факторы, влияющие на состояние сплава, принимают температуру и давление. Применяя правило фаз к металлам, можно во многих случаях принять изменяющимся только один внешний фактор – температуру, т. к.давление, за исключением очень высокого, мало влияет на фазовое равновесие в твердом и жидком состояниях. Тогда общие закономерности существования устойчивых фаз, отвечающих условиям равновесия, в математической форме выражаются правилом фаз (правилом Гиббса) и при постоянном давлении выражается следующим уравнением:
С = К + 1 – 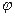 , (4.1)
, (4.1)
где К – число компонентов в системе;  – число фаз; С – число степеней свободы (вариантность системы).
– число фаз; С – число степеней свободы (вариантность системы).
Число степеней свободы С – число независимых внутренних переменных (состав фаз) и внешних (температура, давление) факторов, которые можно менять без изменения числа фаз, находящихся в равновесии. При фазовых превращениях в сплавах вновь образующаяся фаза не обязательно должна иметь более низкий уровень свободной энергии, чем исходная, но обязательно в процессе фазового превращения свободная энергия системы, в целом, должна уменьшаться.
По кривым свободной энергии можно геометрическим путем построить основные типы диаграмм состояния. Их строят в координатах температура–концентрация в процентном содержании по массе.
Для построения диаграмм состояния используют термический анализ, разработанный Н. С. Курнаковым. Экспериментально получают кривые охлаждения отдельных сплавов и по их перегибам или остановкам, связанным с тепловыми эффектами превращений, определяют температуру соответствующих превращений. Эти температуры называют критическими точками.
При изучении превращений в твердом состоянии используют различные методы физико–химического анализа, микроанализа, рентгеноструктурного, дилатометрического, магнитного анализов и др.
В жидком состоянии большинство металлов неограниченно растворяются один в другом, образуя однофазный жидкий раствор. Любые фазы, образующиеся в сплаве, отличаются по составу от исходного жидкого раствора, поэтому для образования устойчивого зародыша необходимы не только гетерогенные флуктуации, но и флуктуации концентрации. Флуктуациями концентрации называют временно возникающие в отдельных малых объемах жидкого раствора отклонения химического состава сплава от среднего его состава. Такие флуктуации возникают в результате диффузионного перемещения атомов вещества и вследствие тепловых движений в жидком растворе. Зародыш новой фазы может возникнуть только в тех микрообъемах исходной фазы, состав которых в результате флуктуации концентрации и расположения атомов соответствует составу и строению новой кристаллизующейся фазы.
Скорость роста кристаллов в жидких растворах меньше, чем в чистых металлах. Это объясняется тем, что рост кристаллов требует диффузионного перемещения атомов компонентов в жидком растворе.
Диаграмма состояния разделена линиями на области. Отдельные области могут состоять только из одной фазы, а некоторые – из двух, имеющих разные составы, строение и свойства.
Анализируя диаграмму состояния, можно составить представление о специфике свойств сплавов данной системы компонентов и характере их изменений в зависимости от состава, а также о возможности термической обработки сплавов и температуре нагрева для ее проведения.
Вид диаграммы определяется характером взаимодействий, которые возникают между компонентами в жидком и твердом состояниях.
4.2. Диаграмма состояния для сплавов, образующих смеси
из чистых компонентов
Общий вид диаграммы для случая, когда оба компонента сплава в жидком состоянии неограниченно растворимы, а в твердом – не растворяются, не образуют химических соединений и не имеют полиморфных превращений, представлен на рис. 4.1. Фазы: жидкость – Ж, кристаллы – А и В.
Линия начала кристаллизации АСВ, является линией ликвидус; линия конца кристаллизации ДСЕ – линией солидус. На линии АС начинают выделяться кристаллы А; на линии СВ – кристаллы В; на линии ДСЕ из жидкости концентрации С одновременно выделяются кристаллы А и В. Эвтектическая смесь двух видов кристаллов, одновременно кристаллизующихся из жидкости, называется эвтектикой.

Рис. 4.1. Общий вид диаграммы состояния и кривые охлаждения сплавов:
1 – заэвтектического; 2 – доэвтектического; 3 – эвтектического
На рис. 4.2 схематически показано строение сплава в разные моменты кристаллизации.
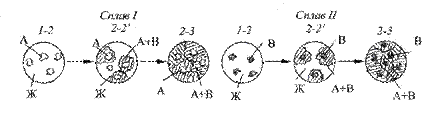
Рис. 4.2. Строение сплавов
Имея диаграмму состояния, можно проследить за фазовыми превращениями любого сплава и указать состав и количественное соотношение фаз при любой температуре. Это определяется по правилу отрезков.
Для определения концентрации компонентов в двух фазах через данную точку а (рис. 4.1), характеризующую состояние сплава, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область. Проекции точек пересечения в и с на горизонтальную ось диаграммы покажут составы фаз в1 и с1. Отрезки этой линии между точкой а и точками в и с, определяющими составы фаз, обратно пропорциональны количествам этих фаз:
Ж = ac/bc; B = ab/bc.
Эти правила справедливы для любой двухфазной области диаграммы состояния.
При оценке прочностных и других свойств сплава следует иметь в виду, что часть сплава, которая представлена эвтектикой, имеет более высокую прочность, чем представленная более крупными зернами избыточной фазы.
4.3. Диаграмма состояния для сплавов с неограниченной
растворимостью в твердом состоянии
На рис. 4.3 приведена диаграмма состояния для сплавов с неограниченной растворимостью компонентов друг в друге в жидком и твердом состоянии, имеющих одинаковые типы решеток и сходное строение наружных электронных оболочек.
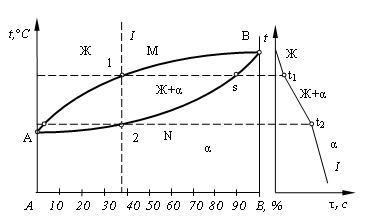
Рис. 4.3. Общий вид диаграммы состояния и кривая охлаждения сплава
Линия АМВ – линия ликвидус; линия АNВ – линия солидус; фаза α представляет собой твердый раствор компонентов А и В, зерна этой фазы имеют единую кристаллическую решетку, но у сплавов разного состава числа атомов компонентов А и В в элементарных ячейках решетки различно.
В случае ускоренного охлаждения сплава при кристаллизации диффузионные процессы не успевают завершиться. В связи с этим центральная часть каждого зерна оказывается обогащенной более тугоплавким компонентом В, а периферийная – легкоплавким компонентом А. Это явление называется дендритной ликвацией, снижающей прочностные и другие свойства сплавов.
Дендритная ликвация может быть устранена путем длительного отжига, который называется диффузионным. Происходящие при этом диффузионные процессы выравнивают химический состав в зернах.
При образовании твердого раствора временное сопротивление при растяжении, предел текучести и твердость повышаются при сохранении достаточно высокой пластичности. Это объясняется тем, что атомы растворенного элемента группируются в искаженных областях решетки, что мешает продвижению дислокаций.
4.4. Диаграмма состояния для сплавов с ограниченной
растворимостью в твердом состоянии, с эвтектикой
На рис. 4.4 приведена диаграмма состояния для сплавов с ограниченной растворимостью компонентов друг в друге в твердом состоянии, с эвтектическим превращением.
Линия АСВ – линия ликвидус; линия АDCEВ – линия солидус; фаза α является твердым раствором компонента В в А; фаза β представляет собой твердый раствор компонента А в В. Кривые DM и EN отражают характер изменения растворимости в зависимости от температуры. Растворимость компонента В в компоненте А уменьшается с понижением температуры (линия DM). Растворимость компонента А в компоненте В не зависит от температуры (линия EN).
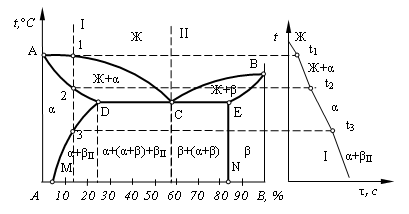
Рис. 4.4. Общий вид диаграммы состояния с ограниченной растворимостью
компонентов эвтектического типа и кривая охлаждения сплава
Рассмотрим кристаллизацию сплава Ι. В точке 1 – начало кристаллизации, в точке 2 – конец кристаллизации твердого раствора α. Эти кристаллы не претерпевают изменений до точки 3, лежащей на линии предельной растворимости DM. Ниже этой точки твердый раствор α является перенасыщенным и выделяет избыточные кристаллы β. Кристаллы β, выделившиеся из твердого раствора, называются вторичными кристаллами и обозначаются βΙΙ. Процесс образования вторичных кристаллов из твердой фазы называется вторичной кристаллизацией. Так как линия EN изображена вертикально, то вторичных выделений α-кристаллов не происходит.
Свойства таких сплавов сильно зависят от дисперсности и характера расположения фаз, их тонкого субзеренного строения, величины зерна и
т. д.
4.5. Диаграмма состояния для сплавов с ограниченной
растворимостью в твердом состоянии, с перитектикой
На рис. 4.5 показана диаграмма состояния для сплавов с ограниченной растворимостью в твердом состояния с перитектическим превращением.

Рис. 4.5. Общий вид диаграммы состояния с перитектическим
превращением и характер кристаллизации
Линия АСВ – линия ликвидус; линия АDEВ – линия солидус; линия CDE – линия перитектического превращения. Перитектическое превращение заключается в том, что жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов.
Рассмотрим кристаллизацию сплава Ι: при понижении температуры в точке 1 происходит выпадение осадков β- раствора, при достижении перитектической горизонтали CDE состав жидкости отвечает точке C, а состав кристаллов – точке E. Обе эти фазы реагируют и дают третью фазу α, концентрация которой определяется точкой D.
Перитектическое превращение происходит по следующей реакции:
ЖС + βE → αD.
Для сплава I перитектическая реакция не приводит к полному затвердеванию, так как наряду с вновь образовавшейся фазой αС сохраняется жидкая фаза:
Ж C + βE → αD + ЖC.
Полное затвердевание сплава произойдет в точке 3, структура сплава будет однофазная.
Для сплава за точкой С перитектическая реакция заканчивается образованием новой α–фазы, но остается избыток β- фазы:
ЖC + βE → αD + βE.
Структура сплава состоит из кристаллов двух типов α- и β -твердых растворов. Получающие смеси характеризуются тем, что фаза, выделившаяся ранее (β -фаза), окружена фазой, выделившейся позднее.
Поиск по сайту: