 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Электронные оболочки
Итак – как же мы объясним периодичность свойств атомов?
Мы пользуемся сейчас моделью, согласно которой электрон движется в атоме по круговой орбите вокруг ядра. Орбиты эти располагаются в атоме не хаотично, и не всей кучей, а сгруппированы в «оболочки». Каждая оболочка может вмещать в себя лишь определенный максимум орбит. Самая первая оболочка обозначается буквой «К» и может вмещать в себе только 2 электрона (или, что то же самое, две орбиты, ведь каждый электрон движется вокруг ядра по орбите). Вторая – «L» - 8. Третья – «М» - тоже 8. Четвертая и пятая – по 18. Шестая и седьмая – по 32.
Итак: каждый электрон размещается на своей орбите. Одна электронная оболочка объединяет несколько близко расположенных друг к другу орбит. «Оболочка» и «орбита» - разные понятия. Одна оболочка состоит из нескольких орбит. «Оболочка» - собирательный термин, примерно как термин «роща» обозначает несколько деревьев.
Открой таблицу Менделеева, чтобы было удобнее следить за текстом. Возьмем атом гелия. В его ядре два протона, и значит должно быть два электрона вокруг ядра. А это значит, что первая электронная оболочка у гелия полностью заполнена. Такой элемент будет химически очень пассивен, так как ему «ничего не надо» - у него все заполнено, и ни отнять электрона, ни добавить. Гелий относится к «инертным газам». Слово «инертный» как раз и подчеркивает, что крайне сложно заставить такие газы вступать в химические реакции.
Прибавим к гелию протон – получится литий. И у лития – три электрона, а на первой оболочке может быть только два. Значит на второй оболочке у лития размещен один электрон. Этот внешний электрон связан с ядром атома намного слабее, чем первые два, просто потому, что между ним и положительно заряженным ядром размещаются два отрицательно заряженных электрона, которые выступают в роли экрана. Поэтому литий легко может отдать свой третий электрон, то есть он легко вступает в химические реакции.
Если мы к ядру лития добавим еще 7 протонов, получим элемент неон с атомным числом 10. Нетрудно заметить, что 10=2+8, а вторая оболочка вмещает в себя как раз максимум 8 электронов. Это означает, что неон, как и гелий, совершенно инертен, в химические реакции почти не вступает – его первые две электронные оболочки полностью заполнены.
Следующий за неоном элемент – уже рассмотренный нами и раньше натрий с порядковым номером 11. То есть у него снова только один электрон на внешней, теперь уже третьей оболочке. Но в химических реакциях в первую очередь участвуют как раз эти самые внешние электроны, поскольку они слабее всех остальных связаны с ядром. К примеру, этот 11-й электрон в атоме натрия экранирован от ядра уже двумя оболочками электронов, и расстояние до ядра становится больше, а сила, с которой притягиваются противоположные электрические заряды, обратно пропорционально даже не расстоянию, а квадрату расстояния между ними! Значит при удалении электрона от ядра, сила их электрического притяжения ослабевает очень быстро, и экранирующий эффект других электронов, расположенных между крайним электроном и ядром, становится все более и более значимым.
Поскольку именно внешние электронные оболочки определяют в основном характер химических реакций, то и неудивительно, что ВСЕ элементы, у которых на внешней оболочке одинаковое количество электронов, ведут себя очень схожим образом в химических реакциях.
Таким образом периодичность свойств элементов объяснена. Ядра-то у них прирастают линейно, один протон за другим, а вот электроны располагаются на оболочках, и когда одна оболочка заполняется полностью, начинается заполнение новой, и все химические свойства идут по кругу, и каждый период в таблице Менделеева начинается щелочным металлом и заканчивается инертным газом.
Атомы щелочных металлов – лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (SC) и франция (Fr) содержат по одному электрону на внешней оболочке, который связан с ядром слабо и легко теряется. Наоборот, в атомах «галогенов»: фтора (F), хлора (Cl), брома (Br), йода (I) и астата (At) не хватает лишь одного электрона на внешней оболочке, и это приводит их в такую ярость (ведь цель заполнения оболочки так близка!), что они с великим энтузиазмом рыщут – где бы стащить электрон. Поскольку они так яростно хотят зацепить электрон, то они добиваются своего в столкновениях практически с любым другим атомом – отнимают электрон, превращаются в отрицательно заряженный ион и после этого, влекомые силой электрического притяжения, вступают в химическую реакцию. Поэтому в свободном виде галогены в природе не встречаются, а только в виде химических соединений.
Теперь понятно и устройство таблицы Менделеева: в первой строчке (эти строчки называются «периодами» два элемента, так как первая оболочка вмещает только два электрона. Во втором и третьем периодах – по 8 элементов. Четвертый и пятый периоды содержат по 18 элементов. Шестой и седьмой – по 32.
Можно спросить – а сколько электронов помещается на восьмой оболочке? А на девятой? Ответ на этот вопрос получить несложно, но большого практического смысла этот ответ не имеет просто потому, что атомы с таким огромным количеством нуклонов в ядре и таким количеством сильно удаленных от ядра электронов попросту не существуют в природе. В лабораторных условиях можно получить некоторые из них, и это делается, но они крайне нестабильны и разваливаются мгновенно на более легкие элементы. Они разваливаются так быстро, что не удается даже исследовать их физические свойства. Тем не менее, физики надеются, что со временем им удастся каким-то хитрым приемом создать некоторые элементы, завершающие седьмой период и составляющие восьмой, поэтому для них даже придуманы временные, «технические» названия. Так, элемент, начинающий восьмой период, назван «унуненний», а галоген из седьмого периода пока назван «унунсептий». Когда их смогут синтезировать, им, конечно, дадут более красивые названия.
Обращает на себя внимание некоторое исключение из правил: водород тоже ведь имеет только один электрон на внешней оболочке, но он не является щелочью и уж точно не металл. Это объясняется тем, что единственный электрон находится очень близко к ядру и не экранируется никакими другими электронами, то есть его связь с ядром намного крепче, чем у щелочных металлов. Поэтому и химические его свойства тоже своеобразны и скорее близки к свойствам инертных газов – только прожженный хищник, супер-сильный электроотрицательный фтор может значительно оттаскивать в свою сторону электрон атома водорода в нормальных условиях. Для того, чтобы водород вступал в реакции с другими веществами, требуются специальные условия, такие как повышенная температура и т.д.
По той же причине унунсептий и унуненний наверняка будут обладать свойствами, сильно отличающимися от свойств галогенов и щелочных металлов – уж слишком сильно они отличаются от тех и других.
На самом деле, устройство электронных оболочек существенно более сложное, и мы потом обязательно вернемся к этой теме и узнаем о существовании s, p, d, f и g-оболочек с разными пространственными конфигурациями, но об этом позже.
«Липкие молекулы». Водородная связь.
Молекула – наименьшая частица вещества, несущая его химические свойства. Она состоит из двух или более атомов, имеет определенную структуру расположения этих атомов. Например, мы можем делить поваренную соль на все более мелкие частички, пока не доберемся до одинокой пары Na+Cl. Эта пара будет иметь все обычные химические свойства соли, но если мы разобьем ее – одинокие атомы натрия и хлора перестанут иметь химические свойства соли, они по отдельности не будут вступать в те же реакции, что и NaCl.
Атом фтора, каким бы голодным он ни был, не может полностью отнять электрон у водорода – он лишь сильно смещает его в свою сторону. Электрон, грубо говоря, становится ближе к центру атома фтора, чем к центру атома водорода.
Это означает, что если провести воображаемую линию через центр молекулы фтороводорода (HF), то у стороны фтора будет отрицательный заряд, а у стороны водорода – равный ему положительный. О таком явлении говорят, что молекула фтороводорода сильно «полярна».
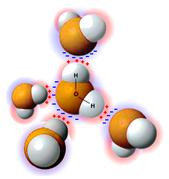 Почти то же самое можно сказать о молекулах воды (H2O) и аммиака (NH3). Такие молекулы имеют положительно и отрицательно заряженные полюса. Что будет, если положительно заряженный конец одной молекулы приблизится к отрицательно заряженному концу другой? Они, конечно, притянутся друг к другу, словно слипнутся.
Почти то же самое можно сказать о молекулах воды (H2O) и аммиака (NH3). Такие молекулы имеют положительно и отрицательно заряженные полюса. Что будет, если положительно заряженный конец одной молекулы приблизится к отрицательно заряженному концу другой? Они, конечно, притянутся друг к другу, словно слипнутся.
Подобного эффекта мы не увидим в молекуле H2S, например (несмотря на то, что ее структура похожа на молекулу воды) – просто потому, что сера – не такой сильный электроотрицательный элемент, как кислород, и не может заметно сдвинуть в свою сторону электрон, принадлежащий водороду. Поэтому H2S не очень полярна.
Атом водорода в молекуле воды граничит с атомом кислорода из той же самой молекулы. Но к этой молекуле в силу ее полярности примыкает еще одна молекула воды, развернутая так, чтобы ее отрицательно заряженная сторона соприкасалась с положительно заряженной стороны первой молекулы. А это значит, что соседняя молекула разместится так, чтобы к атому водорода первой молекулы примыкал атом кислорода второй молекулы. Таким образом атом водорода оказывается «зажат» между двумя атомами кислорода – одним своим и одним из соседней молекулы, и такую связь, за счет которой молекулы воды словно слипаются, называют «водородной». Водородная связь – один из видов химических связей.
Водородная связь слабее обычной химической связи в двадцать раз, но ее наличие оказывает грандиозное влияние на нашу жизнь. Поскольку молекулы воды «слипаются» указанным выше способом, то требуются значительно более высокие температуры, чтобы оторвать их друг от друга, чем если бы молекулы были неполярными. Если бы не было этого эффекта, скрепляющего между собой молекулы воды, вода закипала бы при температуре минус 70 градусов! Какой была бы тогда жизнь, если бы была вообще? В силу повышенной «липкости» молекул, вода может поглощать так много тепла при повышении температуры на каждый градус, ведь ее молекулы тесно связаны между собой, и их трудно «раскачать», то есть трудно повысить температуру воды. Это значит, что если долго и сильно нагревать воду, то ее молекулы начнут лишь немного больше раскачиваться, то есть температура воды поднимается очень медленно, поэтому океан нагревается гораздо медленнее, чем суша, под лучами солнца.
Верно и обратное – вода способна отдавать много тепла при падении температуры, то есть если вода остынет лишь немного, она при этом в окружающую атмосферу отдаст много тепла – столько же, сколько понадобилось, чтобы нагреть воду.
Поэтому мы говорим, что вода имеет чрезвычайно высокую «теплоемкость», то есть ведет себя как огромная теплогубка. Она забирает и отдает больше тепла, чем любое другое вещество при одном и том же изменении температуры, и охлаждается медленнее, работая как термостат, сохраняющий мягкий климат на Земле.
Поиск по сайту: