 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Г) явление неправильных рядов
а) концентрационная коагуляция имеет место, когда она происходит под действием индифферентного электролита, вследствие сжатия диффузного слоя противоионов и уменьшения абсолютного значения ε – дзета потенциала. (Индифферентныйэлектролит – электролит не имеющий ионов, способных достраивать кристаллическую решетку коллоидных частиц.)
Рассмотрим концентрационную коагуляцию золя хлорида серебра, стабилизированного нитратом серебра, при введении в золь нитрата калия.
Формула мицеллы имеет вид:
{[mAgCl]  nAg+ · (n-x)
nAg+ · (n-x)  }x+ · x
}x+ · x 
Далее зарисуем следующий график, показывающий изменение потенциала в ДЭС мицеллы хлорида серебра.

Кривая 1 относится к исходной мицелле.
Кривая 2 после добавления KNO3 в количестве, вызывающем коагуляцию. При добавлении KNO3 диффузный слой противоинов сжимается, формула мицеллы имеет вид: {[mAgCl]  nAg+ · n
nAg+ · n  }
}
На рисунке б представлены потенциальные кривые характеризующие взаимодействие частиц в этом золе.
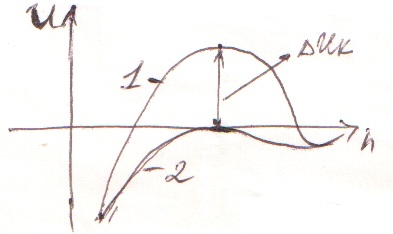 Дзета-потенциал исходной коллоидной частицы положительный, это создает потенциальный барьер коагуляции ∆Uк
Дзета-потенциал исходной коллоидной частицы положительный, это создает потенциальный барьер коагуляции ∆Uк  (кривая 1). Поэтому при столкновении коллоидные частицы отталкиваются друг от друга, коагуляция не происходит.
(кривая 1). Поэтому при столкновении коллоидные частицы отталкиваются друг от друга, коагуляция не происходит.
После добавления нитрата калия дзета-потенциал становится равным нулю и ∆Uк=0 (кривая 2). Поэтому ничто не мешает коллоидным частицам сблизитьсяна на такое расстояние, где преобладают силы притяжения – происходит коагуляция. Т.к. в данном случае причиной коагуляции является увеличение концентрации противоионов, она называется концентрационной коагуляцией.
б) нейтрализационная коагуляция - происходит при добавлении к золю неиндифферентного электролита.
Неиндифферентный электролит – электролит, один из ионов которого способен достраивать кристаллическую решетку дисперсной фазы.
Если рассмотреть золь хлорида серебра, то для нейтрализации потенциалопределяющих ионов Ag+ в золь необходимо ввести хлорид калия. После добавления определенного количества этого неиндифферентного электролита мицелла будет иметь вид: {(m+n) AgCl}. В системе не будет ионов способных адсорбироваться на поверхности частицы AgCl, и поверхность станет электронейтральной.
При столкновении таких частиц происходит коагуляция. Т.к. причиной коагуляции в данном случае является нейтрализация потенциалопределяющих ионов, такую коагуляцию называют нейтрализационной коагуляцией.
в) коагуляция смесью электролитов.
Коагуляция смесью электролитов имеет большое практическое значение.
В технике для коагуляции часто применяют смесь двух электролитов.

При коагуляции золя смесью двух электролитов возможны три случая. На рисунке по оси абсцисс отложена концентрация первого электролита C1, а CK1 его порог коагуляции. Аналогично по оси ординат отложена концентрация второго электролита C2, а CK2 его порог коагуляции.
1. Аддитивное действие электролитов (1 линия) – электролиты действуют как бы независимо друг от друга;
2. Синергизм действия (2 линия) – электролиты как бы способствуют друг другу, и для коагуляции их требуется меньше;
3. Антагонизм действия (3 линия) – электролиты как бы противодействуют друг другу, и для коагуляции их следует добавить больше.
г) явление неправильных рядов – наблюдается при введении в коллоидную систему электролитов содержащих многовалентные ионы (Al+3). Заключается в том, что при добавлении к золю различных возрастающих количеств электролита, золь сначала устойчив, затем неустойчив, далее снова становится устойчив и затем наступает окончание коагуляции.
Поиск по сайту: