 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Глава I. Химическая термодинамика
Термодинамика представляет собой научную дисциплину, которая изучает:
а) переходы энергии из одной формы в другую, от одной системы (части системы) к другой;
б) энергетические эффекты, сопровождающие различные физические или химические процессы;
в) возможность, направление и пределы самопроизвольного течения процессов в заданных условиях.
Термодинамика базируется на двух основных законах, называемых I и II началами термодинамики. Простота и удобство термодинамики состоит в том, что ее представления и вы воды не зависят от состояния и корректности наших знаний о строениии веществ и механизме протекающих процессов.
В термодинамике отсутствует время.
Основные понятия и величины.
Следует точно определить основные понятия, термины и величины, используемые в термодинамике, ибо их нестрогое применение может привести к ошибочным заключениям.
Система - тело или группа тел, находящихся во взаимодействии и обособленные от окружающей среды.
Система называется термодинамической, если в ней происходит энерго- или массообмен.
Система называется изолированной, если она лишена возможности обмена веществом и энергией с окружающей средой.
Под состоянием системы понимают совокупность ее физико-химических свойств.
Термодинамические свойства системы это свойства, зависящие от давления (Р), температуры (Т), объема (V) и концентрации 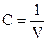 .
.
Давление, температура, объем и концентрация - термодинамические параметры.
Следовательно, состояние системы однозначно определяется уравнением:
 , (1.1)
, (1.1)
называемым уравнением состояния системы.
Энергия (W) - количественная мера движения материи.
Внутренная энергия (U) - одна из форм энергии, не зависящая от положения тела в пространстве, характеристик его движения.
Внутренная энергия равна сумме энергий поступательного, вращательного и колебательного движения всех структурных элементов системы.
Переход системы из состояния 1 в состояние 2 связан с изменением внутренней энергии U1-2=const вне зависимости от пути перехода. То есть изменение внутренней энергии системы не зависит от пути процесса, а определяется лишь исходным и конечным состояниями системы.
Такая функция называется функцией состояния.
Если обратиться к бесконечно малому изменению внутренней энергии системы (dU вместо 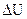 ), то следует отметить, что dU обладает теми же свойствами, что и
), то следует отметить, что dU обладает теми же свойствами, что и 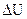 . Дифференциалы, обладающие такими свойствами называют полными дифференциалами функций и вычисляются:
. Дифференциалы, обладающие такими свойствами называют полными дифференциалами функций и вычисляются:
если
U = f (V, T), (1.2)
то
 , (1.3)
, (1.3)
а интеграл по контуру полного дифференциала равен нулю:
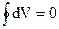 . (1.4)
. (1.4)
Уравнение (1.4) - одна из форм математического изображения I начала термодинамики.
Не все термодинамические функции являются функциями состояния. К ним относятся функции теплота (q) и работа (А). Количество теплоты, выделяемое или поглощаемое системой и количество работы, совершенной системой либо над системой зависят не только от характеристик исходного и конечного состояния системы, но и от того, как происходил переход от одного состояния к другому.
Теплота (q) и работа (А) - формы (способы) передачи энергии от одной системы (части системы) к другой. Бесконечно малые значения теплоты и работы обозначаются соответственно через  и
и 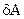 , т. к. знак дифференциала в этих случаях не применяется.
, т. к. знак дифференциала в этих случаях не применяется.
Энтальпия (Н) - термодинамическая функция, являющаяся функцией состояния как и внутренняя энергия (U). Ее величина определяется из простого соотношения:
Н = U + pV, (1.5)
где р - давление;
V - объем системы.
При рассмотрении процессов, происходящих в изохорических условиях удобно пользоваться внутренней энергией, а при рассмотрении изобарных процессов - энтальпией.
Поиск по сайту: