 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Ионные реакции в растворе
Реакции ионного обмена - это реакции между ионами, образовавшимися в результате диссоциации электролитов.
Правила составления ионных уравнений реакций
1. Нерастворимые в воде соединения (простые вещества, оксиды, некоторые кислоты, основания и соли) не диссоциируют.
2. В реакциях используют растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
3. Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
4. Сумма электрических зарядов ионов в левой и в правой части уравнения должна быть одинаковой.
Порядок составления ионных уравнений реакции
1. Записывают молекулярное уравнение реакции MgCl2 + 2AgNO3 = 2AgCl + Mg(NO3)2
2. Определяют растворимость каждого из веществ с помощью таблицы растворимости
| p | p | H | p | |||
| MgCl2 | + | 2AgNO3 | ® | 2AgCl | + | Mg(NO3)2 |
3. Определяем уравнения диссоциации растворимых в воде исходных веществ и продуктов реакции:
(MgCl2 = Mg2+ + 2Cl-; AgNO3 = Ag+ + NO3- Mg(NO3)2 = Mg2+ + 2NO3- )
4. Записываем полное ионное уравнение реакции Mg2+ + 2Cl- + 2Ag+ + 2NO3-=2AgCl¯ + Mg2+ + 2NO3-
5. Составляем сокращенное ионное уравнение, сокращая одинаковые ионы с обеих сторон:
Mg2+ + 2Cl- + 2Ag+ + 2NO3- = 2AgCl¯ + Mg2+ + 2NO3- Ag+ + Cl- = AgCl¯
Условия необратимости реакций ионного обмена
1. Если образуется осадок (¯) (смотри таблицу растворимости)
Pb(NO3)2 + 2KI= PbI2¯ + 2KNO3 Pb2+ + 2I- = PbI2¯
2. Если выделяется газ ()
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 CO32- + 2H+ = H2O + CO2
3. Если образуется малодиссоциированное вещество (H2O, или в таблице растворимости - (м))
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O H+ + OH- = H2O
В тех случаях, когда нет ионов, которые могут связываться между собой с образованием осадка, газа, малодиссоциированных соединений - реакции обмена называются обратимыми
СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ.
(метод электронного баланса) Сущность окислительно-восстановительных процессов состоит в переходе валентных электронов от восстановителя к окислителю. При окислительно-восстановительных реакциях одновременно протекают два взаимосвязанных процесса: окисление и восстановление.
Окисление ― это процесс отдачи электрона. Этот процесс сопровождается повышением степени окисления элемента. Вещество, отдающее электрон, называется восстановителем.
Восстановление ― это процесс присоединения электронов. Этот процесс сопровождается понижением степени окисления элемента. Вещество, принимающее электрон, является окислителем.
Состояние атома в молекуле характеризуется с помощью понятия «степени окисления».
Под степенью окисления понимают заряд атома элемента в соединении, вычисленный из предположения о том, что молекула состоит только из ионов.
Степень окисления ― понятие условное, т.к. большинство соединений не являются ионами, чаще встречаются соединения с ковалентной связью. Степень окисления ― величина переменная. Вычисление степени окисления производится на основании того, что молекула любого вещества в целом электронейтральна, т.е. алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю. Степень окисления атома обозначается арабскими цифрами со знаком (+) или (–) после цифры.
Сравниваем степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем.
Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Рассмотрим этот метод на примере.
Расставить коэффициенты в реакции, схема которой: HCl + MnO2  Cl2 + MnCl2 + H2O Cl2 + MnCl2 + H2O
|
| Алгоритм расстановки коэффициентов |
1.Указываем степени окисления химических элементов.
 Подчёркнуты химические элементы, в которых изменились степени окисления.
Подчёркнуты химические элементы, в которых изменились степени окисления.
|
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов.
 За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное (взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок).ИЛИ ПОЛЬЗУЕМСЯ ПРАВИЛОМ КРЕСТА. Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:
За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное (взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок).ИЛИ ПОЛЬЗУЕМСЯ ПРАВИЛОМ КРЕСТА. Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение:

|
| Рассмотрим более сложное уравнение: |
H2S + KMnO4 + H2SO4  S + MnSO4 + K2SO4 + H2O S + MnSO4 + K2SO4 + H2O
|
Расставляем степени окисления химических элементов:
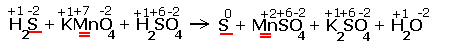
|
Электронные уравнения примут следующий вид
 Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции
Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции
|

|
